
科目: 来源: 题型:
【题目】I 锰元素的化合物在多个领域中均有重要应用。
(1)Mn2+基态核外电子排布式为___,SO32-分子的空间构型为____。
(2)二价锰的3种离子化合物MnCl2、MnS、MnO中晶格能最大的是___。
(3)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为___。
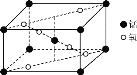
(4)在配离子[Mn(CN)6]3-中存在的作用力有___(填字母)。
a. 离子键 b. 共价键 c. 配位键 d. 氢键
II 铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1)铜与N2O4在一定条件下可制备无水Cu(NO3)2。
①基态Cu的电子排布式为___。
②与NO3-互为等电子体的一种分子为__(填化学式)。
(2)邻氨基吡啶(![]() )的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
)的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
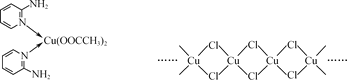
①C、N、O三种元素的第一电离能由大到小的顺序为___。
②邻氨基吡啶的铜配合物中,C原子轨道杂化类型为___。
③1mol![]() 中含有σ键的数目为___mol。
中含有σ键的数目为___mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】“将少量氯水加入到NaI溶液中”的学生实验产生了大量含碘废液.某研究小组用该含碘废液制备NaI固体,实验流程如下:

已知:反应②2I-+2Cu2++SO32-+H2O═2CuI↓+SO42-+2H+。回答下列问题:
(1)产生含碘废液的离子方程式为____________。
(2)①中I2与Na2SO3溶液反应的离子方程式为_________。
(3)化合物B中含两种元素,铁元素与另一种元素物质的量之比为3:8,则化合物B的化学式为____。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则⑤的化学方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
B.某金属元素M由化合态变为游离态,M一定被还原
C.用双线桥表示下列反应的电子转移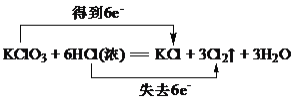
D.非金属单质在反应中只能作氧化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】I某钙钛矿型太阳能电池吸光材料的晶胞结构如图所示,其中A通常为CH3NH3+,可由甲胺(CH3NH2)制得;M为Pb2+或Sn2+;X为卤离子,如Cl-、Br-等。
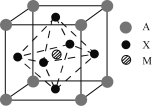
(1)吸光材料的化学式为___(用A、X、M表示)。
(2)H、C、Cl三种元素的电负性由小到大的顺序为____。
(3)溴原子基态核外价电子排布式为___。
(4)甲胺(CH3NH2)极易溶于水,除因为它们都是极性分子外,还因为___。
(5)CH3NH2中N原子的轨道杂化类型为__;1mol CH3NH3+中含σ键的数目为____。
II 镍的单质、合金及其化合物用途非常广泛。
(1)Ni在周期表中的位置为___。
(2)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4的熔沸点比C2H6高的多的原因是____;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为_____。
(3)一种新型的功能材料的晶胞结构如图所示,它的化学式可表示为___。每个Mn周围最近且等距离的Mn数目为___,每个Ga周围最近且等距离的Mn数目为____。
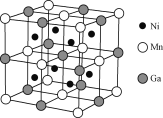
查看答案和解析>>
科目: 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是___,氧化产物是___(填写化学式)。
(2)根据上述反应,鉴别NaNO2、NaCl.可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有______(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是______(填编号)。
A.NaClB.NH4ClC.HNO3D.浓H2SO4
(4)化学方程式:10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O.若反应过程中转移5mole-,则生成标准状况下N2的体积为______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、D、E、G是原子序数依次增大的五种短周期元素,A与E同主族,A、B和E的原子最外层电子数之和为19,B与G的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,D为同周期主族元素中原子半径最大的元素。
(1)B在元素周期表中的位置是______。
(2)D的两种常见氧化物中均含有____________(填“离子键”或“共价键”)。
(3)E的最高价氧化物对应水化物的浓溶液和木炭共热,反应的化学方程式为____________。
(4)D的最高价氧化物对应水化物的溶液与G的单质反应,反应的离子方程式为___________。
(5)用原子结构解释“B、G单质都能与H2反应生成HX型氢化物”的原因:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
实验 | 试剂 | 操作及现象 | ||
试管(I) | 试管(II) | |||
(试管容积为50 mL) | 实验a | 1.0 mol·L-1 FeSO4溶液 24 mL | 1.0 mol·L-1 Na2CO3溶液24mL | 倾倒完后,迅速用胶塞塞紧试管I的口部,反复上下颠倒摇匀,使反应物充分混合 反应过程中无气泡产生,生成白色絮状沉淀 放置1.5~2 h后,白色絮状沉淀转化为白色颗粒状沉淀 |
实验b | 1.0 mol·L-1 FeSO4溶液 10 mL | 1.0 mol·L-1 NaHCO3溶液 20 mL | 倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4 min后液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色 | |
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改成15 mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是_________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:__________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量的聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475g;另一份溶液,先将Fe3+还原为Fe2+,再用0.020mol/LK2Cr2O7标准溶液与之恰好完全反应,消耗K2Cr2O7标准溶液50.00mL。该聚合硫酸铁样品中a:b的比值为
A. 5:4B. 4:5C. 2:1D. 1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室在500 ℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3 和SO2)。下列说法正确的是

A. 取装置①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
C. 装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3
D. 装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的N2
查看答案和解析>>
科目: 来源: 题型:
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com