
科目: 来源: 题型:
【题目】25℃时,向20mL0.1 mol/L H2R溶液中滴加0.1 mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa=﹣lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21。下列有关说法错误的是
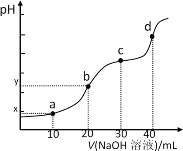
A. 溶液的导电性:点a弱于点b
B. 离子浓度c(R2-):点c小于点d
C. H2R + R2-=2HR-平衡常数>105,反应趋于完全
D. 点b时,y<7且![]() <1
<1
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】根据阿伏伽德罗常数回答下列问题
(1)在0.5mol CO2中含___个O原子,含___个e-。
(2)同温同压下,同质量的氨气和硫化氢气体体积比为____,其中含有的氢原子数目比为____。
(3)___mol H2SO4分子与1.806×1024个H2O分子含有相同的氧原子数?
(4)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为___,R的相对原子质量为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置图所示的实验操作,正确的是( )
A. 干燥Cl2 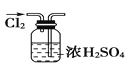
B. 配制100 mL 0.1 mol·L-1 硫酸溶液
C. 分离沸点相差较大的互溶液体混合物 
D. 分离互不相溶的两种液体
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”.

(1)过氧化钠与水反应的化学方程式是__.
(2)装置I是制备纯净的__(填化学式).则装置I中最适宜的试剂组合是__(填字母).
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2.
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃.
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是__;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是__.
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)1mol NH4+质量为_____,其中含质子、电子的数目分别为_____、_____。
(2)标准状态下,672mL某气体质量为0.84g,该气体摩尔质量为_____。
CO 和CO2 混合气体的密度相对氢气为19,则CO 和CO2体积比为_________,若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是____________g;将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/mL,则该盐酸的物质的量浓度是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H< 0,反应到达平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g) △H< 0,反应到达平衡后,为提高CO的转化率,下列措施中正确的是( )
A. 增加压强B. 降低温度或增大H2O(g)的浓度
C. 增大CO的浓度D. 更换催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中,均属于水解反应的是( )
A. HCOOH+H2O![]() HCOO-+H3O+ H2O +H2O
HCOO-+H3O+ H2O +H2O![]() H3O++OH-
H3O++OH-
B. CO2+H2O![]() HCO3-+H+ AlO2-+HCO3-+H2O=Al (OH)3↓+CO32-
HCO3-+H+ AlO2-+HCO3-+H2O=Al (OH)3↓+CO32-
C. CO32-+H2O![]() HCO3-+OH- AlO2-+2H2O
HCO3-+OH- AlO2-+2H2O![]() Al (OH)3+OH-
Al (OH)3+OH-
D. HS-+H2O![]() S2-+H3O+ Fe3++3H2O
S2-+H3O+ Fe3++3H2O![]() Fe(OH)3+ 3H+
Fe(OH)3+ 3H+
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
Ⅰ.制备Cu2O
(1)电解法:工业上用铜作阳极,钛片为阴极,电解一定浓度的NaOH 溶液可制备氧化亚铜,写出阳极的电极反应式为_____________________
(2)微乳液-还原法:在 100℃ Cu(NO3)2 的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。
已知: N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol
Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol
4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol
则由N2H4 和Cu(OH)2 反应制备 Cu2O 的热化学方程式为 ________________________。
Ⅱ.工业上用Cu2O 与 ZnO 组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
(1)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是(_______)
CH3OH(g)已达平衡状态的是(_______)
A.当反应的热效应△H = -90.8 kJ/mol 时反应达到平衡状态
B.在恒温恒压的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒容的容器中,气体的平均摩尔质量不再变化
(2)在 T1℃时,体积为 2 L 的恒容容器中充入物质的量之和为 3mol 的 H2 和CO,当起始 n(H2)/n(CO)= 2 时,经过 5min 达到平衡,CO 的转化率为 0.6,则0~5min 内平均反应速率 v (H2)=___;该温度下的平衡常数为__________________ ;若此时再向容器中加入CO(g) 和 CH3OH(g)各 0.4mol,达新平衡时 H2 的转化率将 ______(填“增大”、 “减小”或“不变”);
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:________。
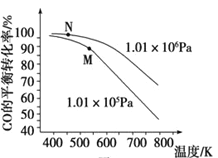
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在容积固定的密闭容器中,发生可逆反应A(g)+2B(g)![]() 2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是( )
2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是( )
A.刚充人时反应速率:v(正)减小,v(逆)增大
B.达到新的平衡时:反应混合物中A.B的物质的量分数不变
C.达到新的平衡时:c(A):c(B):c(C)仍为1:1:2
D.达到新的平衡过程中:体系压强先增大,后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com