
科目: 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B. 一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物,失去的电子数为0.2 NA
C. 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 金属钠着火时使用泡沫灭火器灭火
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:

(1)酸溶及后续过程中均需保持算过量,其目的除了提高铁元素的浸出率之外,还有___________。
(2)操作Ⅰ名称是_______________。
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为_________________。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:_______________________。
(5)加入过量NaOH溶液的目的是__________________。
(6)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体______,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫的含量影响钢铁性能。一种测定硫含量的方法是将钢样中硫转化为二氧化硫气体,再用测硫装置进行测定。某测定硫含量的流程如下:
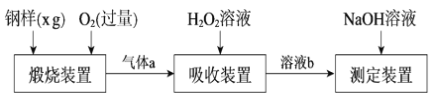
(1)气体a的主要成分有CO2、______、______。
(2)若钢样中硫以FeS的形式存在,煅烧装置中发生的化学反应为3FeS+5O2 ![]() 1______ +3______。___________
1______ +3______。___________
(3)吸收装置中,H2O2氧化SO2的化学方程式是_________________。
(4)用NaOH溶液中和生成的溶液b,消耗z mLNaOH溶液,若消耗1 mLNaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个绝热的、容积固定的密闭容器中,发生可逆反应mA(g)+nB(g)![]() pC(g)+qD(g)(m、n、p、q为任意正整数)。下列能说明该可逆反应达到平衡状态的是( )
pC(g)+qD(g)(m、n、p、q为任意正整数)。下列能说明该可逆反应达到平衡状态的是( )
①混合气体的密度不再发生变化 ②体系的温度不再发生变化 ③A的转化率不再改变 ④各组分的百分含量不再改变 ⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
A. ②③④B. ①③⑤C. ②④⑤D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】一种合成某药物中间体Z的方法如下。下列说法正确的是

A. 1molX最多能消耗溴水中的2molBr2 B. Y可以发生消去反应
C. Z中所有碳原子可以在同一平面 D. 用FeCl3溶液可以检验Z中是否混有X
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关图像的说法正确的是

A. 图甲表示:向某明矾溶液中滴加过量的NaOH溶液,生成沉淀的物质的量与滴加NaOH溶液体积的关系
B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中滴加过量的稀盐酸,生成气体的体积与滴加HCl溶液体积的关系
C. 图丙表示:在稀硝酸溶液中加入过量的铁粉,溶液中Fe3+物质的量与加入铁粉物质的量的变化关系
D. 根据图丁,除去混在KNO3中少量的NaCl可用“蒸发浓缩、趁热过滤”的方法
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目______________。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是____,_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)已知反应:①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④2Na+2H2O=2NaOH+H2↑
⑤2Na2O2+2H2O=4NaOH+O2↑
⑥CaCO3+ CO2+H2O= Ca(HCO3)2
上述反应中不属于氧化还原反应的有_________(填序号,下同);H2O被氧化的是____,H2O被还原的是__________,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是___________。
(2)用双线桥表示下列反应电子转移情况
① KClO3 + 6HCl(浓)= KCl + 3Cl2↑+ 3H2O
__________________________________
② 3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
___________________________________
Ⅱ.(1)配平下列反应方程式
①请将5种物质N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,并配平其反应。__________+__________→__________+__________+__________+____N2O↑
②在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,配平其反应。
____CuO+___NH4Cl ![]() ____Cu+___CuCl2+___N2↑+___H2O。
____Cu+___CuCl2+___N2↑+___H2O。
(2)已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
①含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是_______,被氧化的离子的物质的量分别是_______________。
②若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为_______(用含a、b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】离子反应是中学化学中重要的反应类型,回答下列问题:
Ⅰ.(1)现有下列物质:①石墨②氢氧化钠溶液③CaCO3④HCl⑤熔融氯化钠⑥CH3COOH⑦CH4⑧蔗糖),其中能导电的是_______,属于电解质的是_______,属于非电解质的是_______。(用序号作答)
(2)写出下列反应离子方程式
①NaHCO3溶液与NaHSO4溶液反应:_________。
②NaHCO3溶液与NaOH溶液反应:_______。
Ⅱ.某无色混合物水溶液 ,可能含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。取100mL该溶液进行如下实验:
。取100mL该溶液进行如下实验:
(1)向该溶液中加入足量稀盐酸,在标准状况下放出![]() 气体
气体![]() 气体体积在标准状况下测定,且不考虑气体溶解
气体体积在标准状况下测定,且不考虑气体溶解![]() ;
;
(2)向I中所得的滤液中滴加足量![]() 溶液产生白色沉淀
溶液产生白色沉淀![]() ;试回答下列问题:
;试回答下列问题:
肯定存在的离子有_______,肯定不存在的离子有______; 可能存在的离子是_____; 肯定存在的阳离子在原溶液中的物质的量浓度至少为_____________;
为了检验以上推断,用实验的方法确定溶液中是否存在第一问中肯定存在的阴离子和第三问中可能存在的离子:
第一步:向溶液中滴加过量的________溶液![]() 填化学式
填化学式![]() ,发生反应的离子方程式为___________。
,发生反应的离子方程式为___________。
第二步:加入过量的_________溶液![]() 填化学式
填化学式![]() ,其目的是_____________;
,其目的是_____________;
第三步:过滤,再向滤液中加入___________溶液![]() 填化学式
填化学式![]() ,发生反应的离子方程式为___________。
,发生反应的离子方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和FeCl3溶液滴加到冷水中;
乙:饱和FeCl3溶液滴加到NaOH溶液中;
丙:饱和FeCl3溶液滴加到沸水中。
(1)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为___________
(2)用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论__________
(3)向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因为_______________
②随后发生变化得到和甲相同的溶液,此反应的离子反应方程式为_______
(4)向丙中加入电极通电后,_______极颜色变深(填“阴极”或“阳极”)
(5)可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若_______(填实验现象),则说明该Fe(OH)3胶体中的杂质离子已经完全除去。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com