
科目: 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是

A.Z元素位于周期表的第3周期第VA族
B.X、W元素的最高价氧化物对应水化物的酸性:W强于X
C.Y元素的气态氢化物的热稳定性比Z的低
D.X与W可形成共价化合物XW2
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如下图所示,下列说法不正确的是
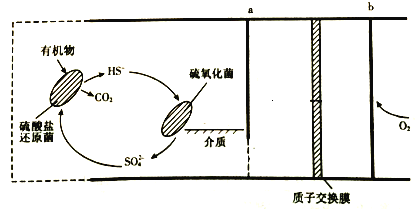
A. 该电池在高温下工作的速度更快
B. HS-在硫氧化菌作用下转化为SO42-的反应是:HS-+4H2O-8e-= SO42-+9H+
C. b是电池的负极
D. 若该电池有0.45 mol 电子转移,则有0.45 mol H+向左通过质子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.3mol/LNaOH溶液480mL。根据溶液的配制情况回答下列问题。
(1)如图所示,配制上述溶液还需用到的玻璃仪器是__(填仪器名称)。
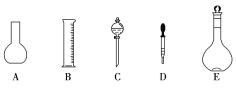
(2)下列操作中,容量瓶所不具备的功能有___(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算,用托盘天平称取NaOH的质量为___g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___(填“偏大”“不变”或“偏小,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,密闭容器中发生反应:A(g)+3B(g) ![]() 2C(g),下列有关说法正确的是
2C(g),下列有关说法正确的是
A.若加入催化剂,则反应的△H 增大
B.加压时,平衡向正反应方向移动,反应的平衡常数增大
C.若反应温度升高,则活化分子的百分数增大,反应速率增大
D.若低温时,该反应为正向自发进行,则△H>0
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各物质物质的量都为1mol,完全燃烧生成二氧化碳和水所消耗相同条件下氧气的量最多的是
A. CH4B. CH3CHOC. C2H5OHD. CH3COOH
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示。则该产物混合气体的平均摩尔质量为___________g· mol-1(保留3位有效数字),该混合烃的平均分子式为________________。

(2)常温下,向20 mL 0.10 mol·L-1HB溶液中逐滴滴入0.10 mol·L-1 NaOH溶液,所得pH曲线如下图所示。则HB是_______酸(填“强”或“弱”),A点对应的溶液中![]() 为_______。
为_______。

查看答案和解析>>
科目: 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:

(1)写出下列物质的化学式:
A是_______________,D是___________,K是_______________。
(2)写出反应“C→F”的离子方程式:_______________________。
(3)写出反应“F→G”的化学方程式:_______________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。
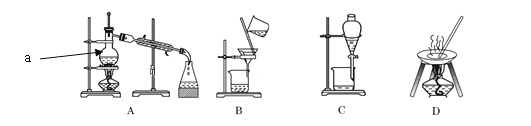
I.请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙___;
(2)氯化钠溶液中分离出氯化钠___;
(3)分离植物油和水___;
(4)海水淡化___;
(5)从碘水中分离出I2___。
II.碘水中提取碘单质的方法如下:
(1)萃取分液
①下列可作为碘水中提取碘单质萃取剂的是___;
A.酒精 B.苯
②分液漏斗在使用前必须先___;
③查资料得知:ρ(H2O)>ρ(苯)>ρ(酒精),若用①中所选萃取剂萃取碘水中的碘单质,分液时,水层应由分液漏斗的___端口放出,有机层应由分液漏斗的___端口放出(此问填“上”或者“下”)。
(2)蒸馏
①装置A中a的名称是___,冷凝装置中冷凝水应该___口进(填“上”或“下”),这样做的目的是___。
②已知碘和四氯化碳的熔沸点数据如下表
熔点 | 沸点 | |
碘 | 113.7℃ | 184.3℃ |
四氯化碳 | -22.6℃ | 76.8℃ |
若用蒸馏法分离碘和四氯化碳的混合物,锥形瓶中先收集到的物质的名称是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(己知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃
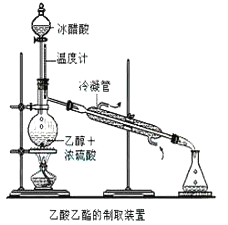
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:_______________。
(3)在该实验中,若用lmol乙醇和lmol乙酸在浓硫酸作用下加热,充分反应,能否生成lmol乙酸乙酯?原因是___________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
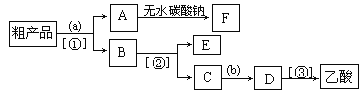
试剂a是__________,试剂b是_______________;分离方法①是________,分离方法②是__________,分离方法③是________________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是____________________。
(6)写出C→D反应的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碲在高端、尖端科技产业日显重要。工业上开发铜阳极泥[主要成分碲化亚铜(Cu2Te),少量Ag、Au]回收碲,其工业流程如下:

(1)碲是ⅥA族元素,Cu2Te中碲元素的化合价为_______________。
(2)“氧化酸浸”中加入足量H2O2的作用是______________。
(3)“滤液②”中主要阴离子是_______________。
(4)“还原”阶段,理论上得到1 mol Te,则消耗_________mol Na2SO3。
(5)CuC2O4分解的化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com