
科目: 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。
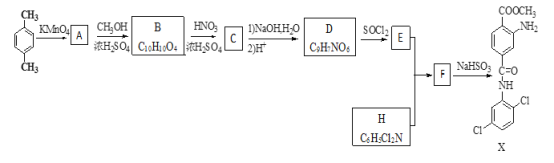
已知:①![]() ②
② ③
③![]() ④
④![]() 。
。
(1)下列说法正确的是_________。
A.化合物A能与能与NaHCO3反应产生气体 B.X的分子式是C15H14Cl2O3N2
C.化合物C能发生取代、还原、加成反应 D.A→B,B→C的反应类型均为取代反应
(2)化合物D的结构简式是_________。
(3)写出E+H→F 的化学反应方程式__________________。
(4)写出化合物B(C10H10O4)同时符合下列条件的两种同分异构体的结构简式______________。
①与NaHCO3溶液反应,0.1mol该同分异构体能产生4.48L(标准状况下)CO2气体;②苯环上的一氯代物只有两种且苯环上的取代基不超过三个;③核磁共振氢谱有五种不同化学环境的氢,且峰面积比为1:2:2:2:3。
(5)设计以乙烯为原料合成制备Y(![]() )的合成路线________________(用流程图表示,无机试剂任选)。
)的合成路线________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是()
A.相同条件下,质量相等的CO和CO2它们所含的氧原子数之比为11:7
B.同体积、同密度的C2H4和CO两种气体的分子数一定相等
C.配制450 mL 0.1 mol﹒L-1NaOH溶液,用托盘天平称取NaOH固体1.8g
D.1L 0.45 mol﹒L-1NaCl溶液中Cl-的物质的量浓度比1 L 0.15 mol﹒L-1 AlCl3溶液大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3 mol电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)________L。
(2)反应②中________作氧化剂,________是氧化产物。
(3)当反应②中生成11.2 L SO2气体(标准状况下)时,被还原的H2SO4的物质的量是________。
(4)用单线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)__________。
(5)反应③中氧化产物与还原产物的物质的量之比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可用于分离或提纯物质的方法有:过滤、蒸发结晶、蒸馏、萃取、分液、洗气。根据需求填下列装置的序号并填上操作名称:


(1)用CCl4提取碘水中的碘,选________,操作名称为________.
(2)用澄清石灰水吸收O2中混有的少量杂质CO2,选________,离子方程式为________。
(3)分离饱和氯化钾溶液与碳酸钙的混合物,选________,操作名称为________。
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物,选________,操作名称为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下:①6.72 LCH4;②3.01×1023个HCl分子;③13.6 gH2S;④0.2 molNH3,下列对这四种气体中含有氢原子数目从大到小表达正确的是( )
A.①③②④B.①③④②C.②③①④D.②④③①
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。回答有关中和反应的问题:
(1)用0.1molNaOH配成稀溶液与足量稀硝酸反应,放出_____热量。
(2)如图装置中缺少的一种玻璃仪器是___,碎泡沫塑料的作用____。
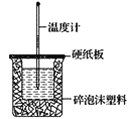
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ·mol-1,其原因可能是____。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热ΔH会___(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下22.4 L CO、CO2的混合气体中含碳原子数为NA
B.1 L1 mol﹒L-1 HCl溶液中含有HCl分子数为NA
C.标准状况下,2.24 L水中氧原子约为NA
D.常温常压下,16 gCH4所含电子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
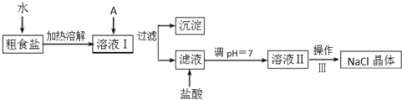
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、Ca(OH)2溶液、BaCl2溶液、Ba(NO3)2溶液
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为________(只填化学式)。
(2)操作Ⅲ的名称是________,所需用到的仪器主要有铁架台、酒精灯、铁圈、玻璃棒__________(填仪器名称)。
(3)加盐酸的目的是(用离子方程式表示)_________________________
Ⅱ.一份无色溶液中可能含有Na+、Fe3+、H+、Mg2+、CO32-、OH-、HCO3-、Cl-、SO42-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
①向溶液中滴加酚酞试液,溶液显红色:
②取2mL溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(4)原溶液中一定存在的离子是______________,一定不能大量存在的离子是_______________。
(5)经过上述操作后,还不能肯定是否存在的离子是________。对可能含有的离子,如何进行实验以进一步检验____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验。实验装置如下图所示,A中盛有浓硫酸,插入一段下端已绕成螺旋状的铜丝,D为玻璃导管。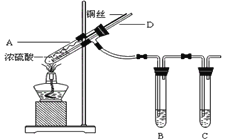
(1)装置A中发生反应的化学方程式为:_________________,该反应中浓硫酸的主要作用有_____________________。
(2)当B中盛有___________时,证明生成的气体产物具氧化性; 当B中盛有___________时,B中溶液颜色褪去,证明生成气体产物具有还原性。
(3)C为尾气处理装置,C中盛放的试剂为________________。
(4)有人建议在A之间B增加一个防倒吸的安全瓶,经该实验小组同学实验后发现,即使不加安全瓶熄灭酒精灯停止反应后,B中的液体也没有发生倒吸,请给出一个合理的解释_______。
(5)实验中,该小组同学取6.4g铜丝和12mL 18mol·L-1H2SO4溶液放在试管中共热充分反应直到反应停止,最后发现烧瓶中还有铜丝剩余;该小组同学根据所学的化学知识判断还会有一定量H2SO4的剩余,下列药品中能够用来验证反应停止后的试管中确有剩余的H2SO4的是________ 。
a.BaCl2溶液 b.Ba(NO3)2溶液 c.银粉 d.小苏打粉末
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨时,在某个密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g)
2NH3(g)
(1)下列能使反应速率加快的是_____________________
①升高温度 ②减小容器体积 ③通入N2 ④通入Ar使压强增大 ⑤通入HCl气体 ⑥加入合适的催化剂
A.①③④⑤ B.①②③⑥ C.①②③④ D.②④⑤⑥
(2)在恒温、恒容的条件下,下列说法能表示反应达到化学平衡状态的是__________
①当有1molN2被消耗,就有2molNH3生成
②当有6molH—H键形成时,就有12molN—H键形成
③2![]() 正(N2)=
正(N2)=![]() 逆(NH3)
逆(NH3)
④N2的物质的量不再变化
⑤H2、N2、NH3的浓度之比等于3:1:2
⑥混合气体的密度不变
⑦混合气体的压强不变
⑧混合气体的平均相对分子质量不变
A.①③④⑤⑦ B.①②③④⑧ C.②③④⑦⑧ D.②④⑤⑥
(3)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)![]() 2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。
2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。

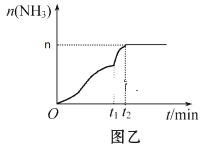
①如图甲,反应开始至平衡时NH3的平均反应速率为_____________________,平衡时氢气的转化率为_________。
②如图乙,下列说法正确的是_________
A.t1时刻可能是加入了催化剂
B.改变条件可以使H2 100℅转化为NH3
C.增大N2的浓度,可以提高H2的转化率
D.t2时刻,N2的浓度与NH3的浓度之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com