
科目: 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀硫酸与Ba(OH)2溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列十种物质:①HCl;②NaHCO3;③K2SO4溶液;④CO2;⑤蔗糖晶体;⑥Ca(OH)2;⑦氢氧化铁胶体;⑧NH3·H2O;⑨空气;⑩Al2(SO4)3
(a)上述物质中属于电解质的有_____________,非电解质的有_____________(填序号)。
(b)②在水溶液中的电离方程式为____________________________________________
(c)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,如果病人同时患胃溃疡,为防胃壁穿孔,不宜服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式:_____
(d)若⑦中混有少量的③,提纯的方法是:_________
A.蒸馏 B.萃取 C.渗析 D.分液
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
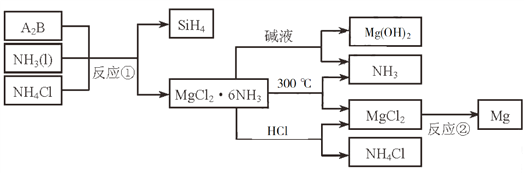
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
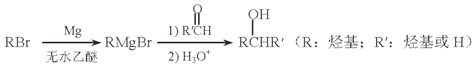
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)明胶溶于水所形成的分散系和K2SO4溶液共同具备的性质是_______。
a.很稳定,煮沸都无明显变化 b.两者均有丁达尔现象 c.分散质粒子可通过滤纸
(2)现需配制0.5mol·L-1 K2SO4溶液480mL。
①配制溶液时必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、__________、__________、以及等质量的几片滤纸。
②配制该溶液需称取K2SO4固体的质量为_____________
③下列关于容量瓶的使用方法中,正确的是________
A.容量瓶可长期存放溶液 B.在容量瓶中直接溶解固体
C.溶液未经冷却即注入容量瓶中 D.向容量瓶中转移溶液要用玻璃棒引流
④下列操作会使所配溶液浓度偏低的是___________
A.洗净的容量瓶瓶底有少量水 B.称量时药品和砝码放反
C.定容时俯视刻度线 D.移液后烧杯和玻璃棒未洗涤
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
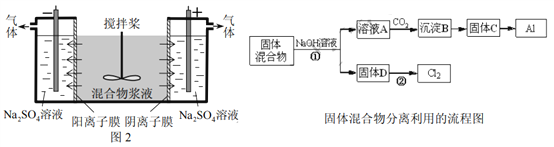
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某澄清溶液含有下列离子中的5种(忽略水的电离及离子的水解),K+、Na+、Ag+、Cu2+、Al3+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等.为探究溶液中离子组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
④另取溶液倒入足量的高浓度氢氧化钠,无明显现象,后再加入适量盐酸有白色絮状物生成。根据上述实验,以下推测正确的是( )
A.溶液中无法确定NO3-的存在B.原溶液中不含的离子为:K+、Ag+、Cu2+、CO32-
C.步骤①中可以确定Na+的存在D.步骤③中共有2种钡盐沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断错误的是( )
A.在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:OH-、CO32-、AlO2-
B.在含等物质的量的CO32-、HCO3-的溶液中,逐滴加入盐酸:CO32-、HCO3-
C.在含等物质的量的K2CO3、KOH的溶液中,缓通入CO2:KOH、K2CO3
D.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
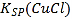
A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目: 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )
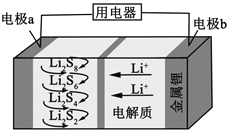
A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com