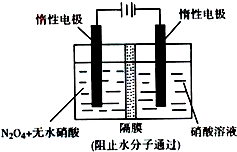
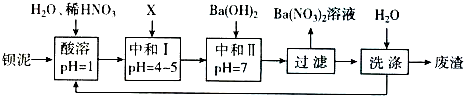
铝镁合金是飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁30/0-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
【方案一】
【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.
实验中发生反应的化学方程式是
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【实验步骤】
(1)称取10.8g铝镁合金粉末样品,溶于VmL4.0mol?L
-1'NaOH溶液中,充分反应.则NaOH溶液的体积V≥
97mL
97mL
.
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将
偏高
偏高
(填“偏高”、“偏低”或“无影响”).
【方案二】
【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积.
(1)同学们拟选用如图1所示实验装置完成实验:

你认为最简易的装置其连接顺序是:A接
E
E
接
D
D
接
G
G
(填接口字母,可不填满.)
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了如图3所示的实验装置.
①装置中导管a的作用是
保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差
保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差
.
②实验前后碱式滴定管中液面读数分别为V
1mL、V
2mL.则产生氢气的体积为
V1-V2
V1-V2
mL.
③若需确定产生氢气的量,还需测定的数据是:
温度
温度
,
压强
压强
.



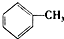 成一种药物K,其合成路线设计如下:
成一种药物K,其合成路线设计如下:
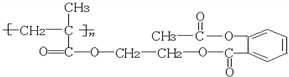
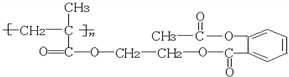




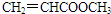 、
、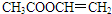 、
、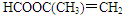 中任意2个
中任意2个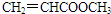 、
、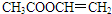 、
、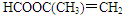 中任意2个
中任意2个