
科目: 来源: 题型:
【题目】Na2S2O35H2O俗称“海波”,是重要的化工原料,常用作脱氯剂、定影剂和还原剂。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式是_____。
(2)测定海波在产品中的质量分数:依据反应2S2O32﹣+I2=S4O62﹣+2I﹣,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉溶液为指示剂,用浓度为0.05000molL﹣1I2的标准溶液进行滴定,相关数据记录如表所示。

①判断滴定终点的现象是_____。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O35H2O的质量分数会_____(填“偏高”、“偏低”或“不变”)
③计算海波在产品中的质量分数(写出计算过程)。_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】慢心律是一种治疗心律失常的药物。它的合成路线如图所示。
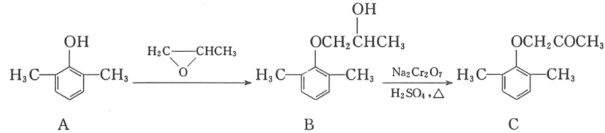
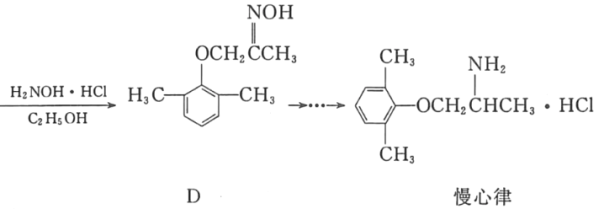
(1)C中的含氧官能团名称为_____和_____;
(2)由B→C的反应类型是_____。
(3)由A制备B的过程中有少量副产物E,它与B互为同分异构体。写出E的结构简式:_____。
(4)写出同时满足下列条件的化合物D的一种同分异构体的结构简式:_____。
①属于a﹣氨基酸;②是苯的衍生物,且苯环上的一氯代物只有两种;③分子中有2个手性碳原子
(5)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷(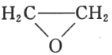 )。写出以邻甲基苯酚(
)。写出以邻甲基苯酚( )和乙醇为原料制备
)和乙醇为原料制备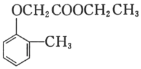 的合成路线流程图(无机试剂任用)。合成路线流程图示例见本题题干_____。
的合成路线流程图(无机试剂任用)。合成路线流程图示例见本题题干_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
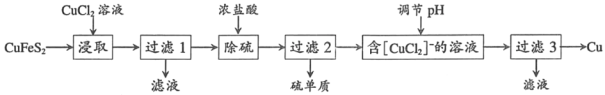
已知:CuFeS2+3CuCl2=4CuCl+FeCl2+2S
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_____.
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为_____.
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是_____.(填离子符号)
(4)过滤3所得滤液中可以循环使用的物质有_____,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为_____.
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2![]() 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2![]() 2Cu+SO2此工艺与前一工艺相比主要缺点有_____.
2Cu+SO2此工艺与前一工艺相比主要缺点有_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O22SO3,其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )
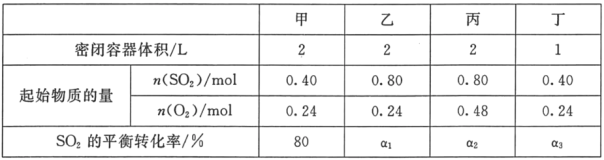
A.该温度下,该反应的平衡常数K为400
B.SO2的平衡转化率:a1>a2=a3
C.达到平衡时,容器丁中的正反应速率比容器丙中的大
D.达到平衡时,容器丙中c( SO3)大于容器甲中c( SO3)的两倍
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。
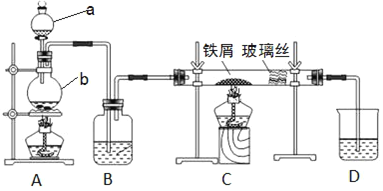
(1)写出仪器的名称:a_______,b________。
(2)A中反应的化学方程式为________。C中反应的化学方程式为________。
(3)装置B中加入的试剂是________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置__和__(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:________。
(6)反应结束后,取少量装置C中的固体于试管中,加入足量盐酸,固体完全溶解,得到溶液X。证明溶液X中含有FeCl3的试剂是________,观察到的现象是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】充分加热如图所示的密闭容器中放置有固体试剂的两个位置, 若钠与氧化银均反应完全且恢复到原来的温度,U形管左右两侧液面相平。下列有关说法中错误的是

A. 反应前后装置内空气的成分保持不变
B. 反应前装置内钠与Ag2O物质的量之比为2:1
C. 热稳定性:生成的钠的氧化物强于Ag2O
D. 反应后有淡黄色固体生成
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。请根据以下流程图,回答下列问题。

(1)写出下列标号所代表的物质的名称(注意用量)或操作方法③_____,⑥_____。
(2)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是______,现象依次是_______,并写出对应反应的离子方程式:_______,______。
(3)若取2mL溶液④加入试管中,然后滴加氢氧化钠溶液,此过程涉及的氧化还原反应的化学方程式是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将0.1molL﹣1 NaOH溶液加入20mL0.1molL﹣1CH3COOH溶液中,所加入溶液的体积(V)和混合液的pH关系曲线如图所示。下列结论正确的是( )

A.①点时,c(CH3COO﹣)+c(CH3COOH)=c(Na+)
B.对曲线上①②③任何一点,溶液中都有c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
C.③点时,醋酸恰好完全反应完溶液中有c(CH3COO﹣)=c(Na+)>c(H+)=c(OH﹣)
D.滴定过程中可能出现c(H+)>c(Na+)>c(CH3COO﹣)>c(OH﹣)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系:

(1)确定A、B、C、D、E、F的化学式,A为________,B为________,C为________,D为________,E为________,F为________。
(2)写出⑧的化学方程式,④、⑤的离子方程式。
⑧_________________________________________________,
④________________________________________________,
⑤___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物Y能用于高性能光学树脂的合成,可由化合物X与2﹣甲基丙烯酰氯在一定条件下反应制得:
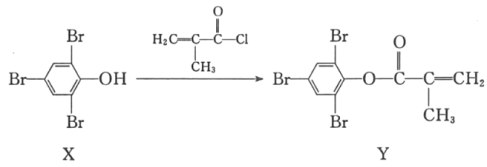
下列有关X、Y的说法正确的是( )
A.X分子中所有原子一定在同一平面上
B.Y与Br2的加成产物分子中含有手性碳原子
C.X、Y均不能使酸性高锰酸钾溶液褪色
D.可以用FeCl3溶液鉴别X和Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com