
科目: 来源: 题型:
【题目】通过对煤的综合利用,可以获得多种有机物。化合物A含有碳、氢、氧3种元素,其质量比是12∶3∶8。液态烃B是一种重要的化工原料,其摩尔质量为78g·mol-1。E是有芳香气味的酯。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):

请回答:
(1)化合物A的结构简式是____________。
(2)A与D反应生成E的反应类型是____________。
(3)E与氢氧化钠溶液发生水解化学方程式是________________________。
(4)下列说法正确的是____________。
A.将铜丝在空气中灼烧后迅速插入A中,反复多次,可得到能发生银镜反应的物质
B.在一定条件下,C可通过取代反应转化为![]()
C.苯甲酸钠(常用作防腐剂)可通过D和氢氧化钠反应得到
D.共a mol 的B和D混合物在氧气中完全燃烧,消耗氧气大于7.5a mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目: 来源: 题型:
【题目】固体粉末甲由FeSO4、Fe2(SO4)3、CuSO4、CaCO3、SiO2、NaCl中的若干种组成,取一定量的固体甲进行如下实验:
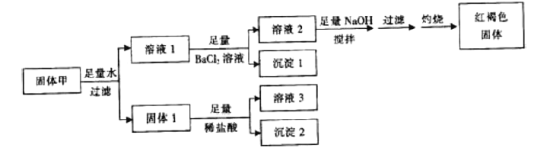
固体1质量为11g,沉淀1质量为23.3g,沉淀2质量为6g,红褐色固体质量为8g。下列说法正确的是( )
A. 溶液Ⅰ加入KSCN溶液呈红色
B. 取少量溶液2加入酸化的硝酸银溶液,生成白色沉淀,则甲中一定有NaCl
C. 固体Ⅰ与稀盐酸反应时还生成了标准状况下气体1.12L
D. 沉淀2不溶于任何酸溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:X、Y、Z是三种常见元素,X原子核内只有一个质子,Y原子的最外层电子数是次外层的三倍,且X、Y、Z均能形成中学常见的双原子气体单质,并有如下转化关系:
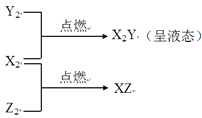
请回答下列问题:
(1)写出Y2的化学式____________。
(2)X2分别在Y2、Z2中点燃时火焰的颜色是________、_________。
(3)Z2与X2Y反应生成两种酸,其化学方程式为 ___________________。
(4)Z2与NaOH溶液反应的化学方程式为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 0.1 mol·L-1NaClO溶液中含有的ClO-为NA
B. 1 mol Fe在1 mol Cl2中充分燃烧,转移的电子数为3NA
C. 常温常压下,32 g O2与O3的混合气体中含有的分子总数小于NA
D. 标准状况下,22.4 L HF中含有的氟原子数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)含有相同碳原子数的CO和CO2,其质量比为________。
(2)标准状况下有①44.8L CH4,②9.03×1023个NH3分子,③85g H2S三种气体,这三种气体的物质的量从大到小的顺序是________。
(3)若1g CO2中含有x个原子,则阿伏加德罗常数可表示为________。
(4)4.9g H2SO4含________个H2SO4分子,能和________mol NaOH完全反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ge、Na及其化合物在航空航天、电子工业上有重要应用。请回答下列问题:
(1)基态Ge原子价层电子的排布式为___,其电子填充的最高能级的轨道数为___。电子占据最高能级的电子云轮廓图为___形。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是___。
(3)硼氢化钠(NaBH4)是有机化学中的一种常用还原剂,[BH4]-的空间构型是__,中心原子的杂化形式为___。NaBH4中存在___(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)NaC1是离子晶体,其晶格能可通过下图的循环计算得到。
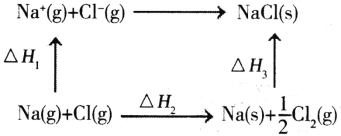
△H(晶格能)=___。
(5)Na2O的立方晶胞如图所示,氧离子采取面心立方堆积,钠离子填在由氧离子形成的__空隙中。已知晶胞边长a=0.566nm,晶胞中O原子的配位数为__;该晶体的密度是___g·cm-3(列出计算表达式)。
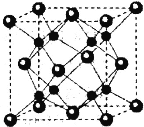
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. “春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是蛋白质和烃
B. 淀粉、纤维素、麦芽糖在一定条件下可和水作用转化为葡萄糖
C. 全降解塑料![]() 可由环氧丙烷
可由环氧丙烷![]() 和CO2缩聚制得
和CO2缩聚制得
D. 皂化反应是指油脂在稀硫酸的作用下水解得到高级脂肪酸和甘油
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、J、Q、W为前四周期元素,原子序数依次增大。元素Y在地壳中含量最高,W的一种常见高价氧化物是红棕色粉末,常用于油漆、涂料、油墨的红色染料,25℃X、Z、J、Q的最高价氧化物对应水化物溶液(浓度均为0.01mol·L-1)的pH与原子序数的关系如图所示。
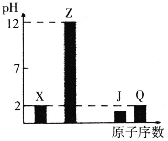
根据上述信息进行判断,并回答下列问题:
(1)W在周期表中的位置__。比较X、Y、Z的简单离子半径大小为__<____<__(用离子符号表示);
(2)元素的非金属性Y__J(填“>”或“<”)。下列各项中,不能说明这一结论的有__(填序号)。
A.J的氢化物的水溶液放置在空气中会变浑浊
B.Y与J之间形成的化合物中元素的化合价。
C.Y和J的单质的状态
D.Y和J在周期表中的位置
(3)X、J、Q这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_____(填化学式);酸根呈三角锥结构的酸是___(填化学式)。
(4)Y和Q形成的化合物Q2Y的立体构型为__,Q的单质与湿润的Na2CO3反应可制备Q2Y,其化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com