
科目: 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
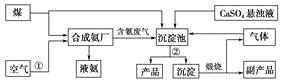
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
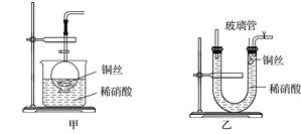
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
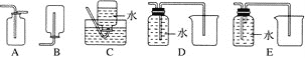
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的主要因素是
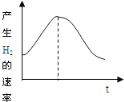
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④ B. ③④ C. ①③ D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氮原子的氮气在标准状况下的体积约为22.4L
B.标准状况下,11.2L![]() 含有的分子数为0.5NA
含有的分子数为0.5NA
C.在常温常压下,11.2 L![]() 含有的分子数为0.5NA
含有的分子数为0.5NA
D.![]() 和
和![]() 的混合物,所含氧原子数为0.2NA
的混合物,所含氧原子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0molL﹣1稀硫酸,
(1)需量取浓硫酸的体积为_____mL。
(2)配制溶液时,一般可以分为以下几个步骤:①量取 ②计算 ③溶解 ④颠倒摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为________________,本实验必须用到的仪器有量筒、玻璃棒、烧杯、胶头滴管、还有___________。
(3)在配制过程中,下列操作会引起浓度偏高的是____,无影响的是____(填序号)。
①没有洗涤烧杯和玻璃棒;
②转移溶液时不慎有少量洒到容量瓶外面;
③容量瓶不干燥,含有少量蒸馏水;
④定容时俯视刻度线;
⑤未冷却到室温就将溶液转移到容量瓶并定容;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.10mol·L的氨水滴定l0.00mL0.05mol·L-1H2A溶液,加入氨水的体积(V)与溶液中lg![]() 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
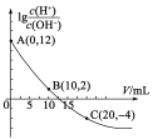
A.A点溶液的pH等于1
B.由图中数据可知,H2A为弱酸
C.B点水电离出的H+离子浓度为1.0×10-6mol·L-1
D.C点溶液中![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某科研小组设计出利用工业废酸(稀硫酸)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示。

已知:各离子开始沉淀及完全沉淀时的pH如表所示:
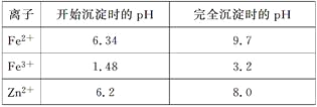
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是(任写一点即可)__________________________________________________________。
(2)物质A最好使用下列物质中的____________(填选项序号)。
A.KMnO4 B.H2O2 C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在__________范围之间。
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的氢氧化铁可用次氯酸钾溶液在碱性环境将其氧化得到一种高效的多功能处理剂(K2FeO4),写出该反应的离子方程式:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种制备高效漂白剂NaC1O2的实验流程如图所示,反应I的化学方程式为: 3NaC1O3+4SO2+3H2O=2C1O2+Na2SO4+3H2SO4+NaCl,下列说法正确的是
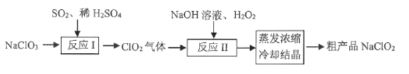
A.NaClO2的漂白原理与SO2相同
B.反应I中氧化产物和还原产物物质的量比为4:3
C.反应II中H2O2做氧化剂
D.实验室进行蒸发操作通常在坩埚中进行
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)0. 6 g H2中含有氢原子的物质的量为_________ mol。
(2)标准状况下,含有相同氧原子数的CO和CO2的体积之比为____________。
(3)100mL硫酸钠溶液中n(Na+)=0.2mol,则其中c(SO42-)=_____________。
(4)6.72L(标准状况)CO与一定量的Fe2O3恰好完全反应,生成Fe的质量为____________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下有①6.72L CH4,②3.01×1023个HCl分子,③13.6g硫化氢,④0.2mol氨气(NH3)。下列对这四种气体的关系从大到小描述不正确的是( )
A.体积②>③>①>④B.密度②>③>④>①
C.质量②>③>①>④D.氢原子数①>④>③>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com