
科目: 来源: 题型:
【题目】写出下列水溶液中的电离方程式或发生反应的离子方程式:
(1)小苏打溶于水___;
(2)用稀硫酸除掉镁条表面的氧化膜___;
(3)用胃舒平(有效成分是Al(OH) 3)治疗胃酸(主要成分是盐酸)过多___;
(4)用锌粉除去硫酸钾溶液中的Cd2+杂质(置换反应)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】“84”消毒液(有效成分为![]() )可用于消毒和漂白,下列实验现象的分析不正确的是
)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 | ①
| ② | ③
|
实验现象 | 混合后溶液的 | 混合后溶液 | 混合后溶液 |
A. 对比实验①和②,②中蓝色迅速褪去的原因是发生了反应![]()
B. 实验③中产生的气体是![]() ,由
,由![]() 分解得到:
分解得到:![]()
C. 对比实验②和③,溶液的![]() 可能会影响
可能会影响![]() 的氧化性或
的氧化性或![]() 的还原性
的还原性
D. 加酸可以提高“84”消毒液的漂白效果,但需要调控到合适的![]() 才能安全使用
才能安全使用
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识回答下列问题:
(1)标准状况下,___gCO和4.48LCO2所含的分子数目相同,两种气体的碳原子数之和为___。
(2)将标况下6.72LHCl气体溶于水,配成100mL溶液,得到物质的量浓度为___的盐酸溶液。
(3)已知8gA与32gB恰好完全反应,只生成0.5molC和18gD,则C的摩尔质量为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.![]()
II.![]()
(1)则![]() 的△H= ________(用△H1、△H2表示)
的△H= ________(用△H1、△H2表示)
(2)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______反应(填”吸热”’或”放热”)。
(3)在恒容密闭容器中发生反应I:
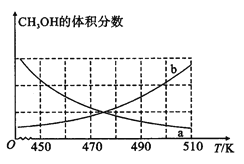
①如图能正确反映体系中甲醇体积分数随温度变化情况的曲线是____(填“a”或“b”)。
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(4)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则:
① 0~4min,反应I的v(H2)=________,反应I的平衡常数K=________。
②反应II中CH3OH的转化率α=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol/L 的硫酸溶液:Ba2+、Ag+、SO32-、CH3COO-
B.能使石蕊试液变红的溶液:Ca2+、NH4+、Cl-、NO3-
C.无色透明溶液:K+、Cu2+、I-、CO32-
D.离子浓度均为0.1mol/L 的溶液:Na+、Ba2+、HCO3-、OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】I.如图所示,是原电池的装置图。

请回答:
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为________________________;反应进行一段时间后溶液C的pH将________(填“升高”“降低”或“基本不变”)
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

电池总反应为2CH3OH+3O2===2CO2+4H2O,
①则c电极是_______(填“正极”或“负极”),c电极的反应方程式为____________________________。
②若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为________L。
II.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:

(1)写出电解饱和食盐水的离子方程式:____________________________________________。
(2)精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中______位置流出(选填“a”、“b”、“c”或“d”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,2.24LH2O含有的分子数为0.1NA
B.常温常压下,1.06gNa2CO3含有的Na+数目为0.02NA
C.0.1mol/L的MgCl2溶液中,含有Cl-数目为0.2NA
D.将0.lmolNaCl粉末分散于乙醇中制成胶体,则其中含有的胶体粒子数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】向一定体积CaCl2和HCl的混合溶液中逐滴加入浓度为1 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
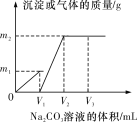
已知图中V1∶V2=1∶2;当加入V2 mL Na2CO3溶液时,所得溶液的浓度为1 mol·L-1,体积为200 mL。求:
(1)加入V2 mL Na2CO3溶液时,所得溶液的溶质是________。
(2)原混合溶液中CaCl2和HCl的物质的量之比n(CaCl2)∶n(HCl)=________。
(3)m1=________g,m2=________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是
A.①和②中发生的反应均为复分解反应
B.向Na2SiO3饱和溶液中滴酚酞溶液无明显现象
C.一段时间后②中有胶冻状物质生成
D.该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型绿色消毒剂,其在消毒(发生氧化还原反应)后可形成Fe(OH)3胶体,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
(1)干法制备高铁酸钾时,先制备得到Na2FeO4,反应如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中,氧化剂是________,氧化产物是________。
②每生成1 mol Na2FeO4,转移________mol电子。
(2)配平湿法制备高铁酸钾反应的离子方程式:
______Fe(OH)3+______ClO-+______OH-===______FeO42-+______Cl-+______H2O
(3)取少量K2FeO4溶液,滴加盐酸,有Cl2产生,该反应表明氧化性:K2FeO4______(填“>”或“<”)Cl2。
(4)Fe(OH)3胶体可使水中悬浮物沉降下来,用作净水剂。
①实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是_____________________。
②下列有关胶体的说法不正确的是________(填字母代号)。
a.光束通过Fe(OH)3胶体时形成光亮的“通路”
b.往Fe(OH)3胶体中加入稀硫酸,先出现红褐色沉淀,后沉淀溶解消失
c.Fe(OH)3胶体粒子不能透过滤纸,能透过半透膜
d.Fe(OH)3胶体发生电泳时,其胶体粒子向阴极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com