
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B.标准状况下,2.24L NO和2.24L O2混合后气体分子数为0.15 NA
C.0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA
D.加热条件下,1mol Fe投入足量的浓硫酸中,生成NA个SO2分子
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)分别取m g钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是____________________。
(2)分别取0.1 mol 钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是________________________。
(3)若都产生0.25 mol的氢气,所需钠、铁、铝的质量比是________________________。
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝三种金属的物质的量之比是________________________。
(5)若产生相同质量的氢气,钠、铁、铝三种金属转移电子的物质的量之比是________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等。
(1)下列ΔH表示物质燃烧热的是_____(填ΔH1、ΔH2或ΔH3,下同);表示中和热的是____。
A. 2H2(g)+O2(g)=2H2O(l) ΔH1
B. C(s)+ O2(g)=CO(g) ΔH2
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3
D. C(s)+ O2(g)=CO2(g) ΔH4
E. C6H12O6(s)+6O2(g)=6CO2(g) +6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)=NaSO4(aq)+2H2O(l) ΔH7
(2)已知15g乙烷完全燃烧生成CO2和液态水,放热akJ,下列热化学方程式正确是(________)。
A. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH1=+2a kJ·mol-1
B. C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH1=-2a kJ·mol-1
C. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ΔH1=-4a kJ·mol-1
D. 2C2H6(g)+ 7O2(g)=4CO2(g)+6H2O(l) ΔH1=+4a kJ·mol-1
(3)充分燃烧一定量丁烷(C4H10)放出热量161.9kJ,且生成的CO2恰好能与2.5mol/L 100mL的氢氧化钡溶液完全反应生成沉淀,则燃烧1mol丁烷放出能量为__________。
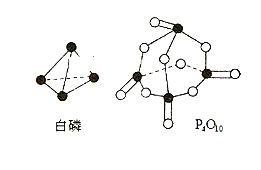
(4)进一步研究表明,化学反应能量变化与键能有关,键能简单理解断开1mol化学键吸收能量。下表是键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 197 | 360 | 499 | X |
已知白磷燃烧热为2378.0kJ·mol-1,则X=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在甲、乙两个恒容的密闭容器中进行下列两个可逆反应:甲容器中![]() ;乙容器中
;乙容器中![]() 。现有下列状态:①混合气体的平均相对分子质量不再改变;②恒温时,气体压强不再改变;③各气体的浓度相等;④反应体系中温度保持不变(假设为绝热容器);⑤相同时间内,断裂H—O键的速率是断裂H-H键速率的2倍;⑥混合气体密度不变;⑦单位时间内,消耗水蒸气的质量与生成氢气的质量之比为9:1。其中能表明甲、乙两容器中反应都达到平衡状态的是( )
。现有下列状态:①混合气体的平均相对分子质量不再改变;②恒温时,气体压强不再改变;③各气体的浓度相等;④反应体系中温度保持不变(假设为绝热容器);⑤相同时间内,断裂H—O键的速率是断裂H-H键速率的2倍;⑥混合气体密度不变;⑦单位时间内,消耗水蒸气的质量与生成氢气的质量之比为9:1。其中能表明甲、乙两容器中反应都达到平衡状态的是( )
A. ①②B. ③④⑥C. ⑥⑦D. ④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如下图所示,则比较下列大小关系:
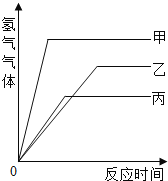
(1)三种金属的活动性由强到弱的顺序为:________________________。
(2)三种金属反应时消耗硫酸的质量由少到多的顺序为:_____________。
(3)三种金属的相对原子质量由大到小的顺序为:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某一反应体系有反应物和生成物总共有5种物质:O2 、H2CrO4 、Cr(OH)3 、H2O、H2O2。已知该反应中H2O2 发生如下变化过程:H2O2 → O2 ,则有:
(1)该反应中的氧化产物_________________________;
(2)配平该反应的化学方程式并用单线桥表示电子转移情况:__________________________________________。
(3)现有反应:3BrF3 + 5H2O = HBrO3 + Br2 + 9HF + O2↑,已知BrF3中F的化合价为-1价,则有该反应中的氧化剂是____________,若生成0.5 mol Br2,则反应过程中转移电子为__________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一条鱼、虾绝迹的小河边有四座工厂甲、乙、丙、丁(如图),它们排出的废液里,每个工厂只有 Na2CO3、CuCl2、Ca(OH)2、HCl 中的一种。某中学环保小组对河水监测时发现:① 甲处河水澄清且呈蓝色;② 乙处河水由乳白色浑浊变浅蓝色浑浊;③ 丙处河水由浑变清;④ 丁处产生气泡,河水仍清,请推断:

(1)四座工厂排除的废液里含有的污染物:甲_______,乙________,丙_______,丁________。
(2)在M处取出的河水中,肯定含有的离子是____________________。
(3)写出丙厂处可能发生的离子方程式______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是
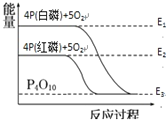
A.红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ mol-1
B.P4(s,白磷) = 4P(s,红磷) ΔH>0
C.白磷比红磷稳定
D.以上变化中,白磷和红磷所需活化能相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于指定粒子构成的几种描述中正确的是
A.![]() C与
C与![]() C是不同的核素,所以分别由这两种原子构成的石墨化学性质不同
C是不同的核素,所以分别由这两种原子构成的石墨化学性质不同
B.H2O和D2O是同分异构体
C.H3O+与-OH具有相同的电子数
D.37Cl与39K具有相同的中子数
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用密度为1.84 gcm﹣3、溶质的质量分数为98 %的硫酸,配制250 mL物质的量浓度为0.46 molL﹣1的硫酸。
(1)需要量取该浓硫酸的体积为_______mL。
(2)实验需要以下步骤:
①定容 ②量取 ③摇匀 ④洗涤 ⑤转移 ⑥冷却 ⑦计算 ⑧装瓶 ⑨稀释
进行顺序为_______。
(3)下列操作使所配溶液的物质的量浓度偏高的是________。
A.往容量瓶中转移溶液时有少量液体溅出
B.未洗涤稀释浓H2SO4的小烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com