
科目: 来源: 题型:
【题目】某有机化合物A经李比希法测得其中碳的质量分数为70.59%,氢的质量分数为 5.88%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构,A的质谱图、核磁共振氢谱、红外光谱图分别表示如下:
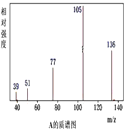
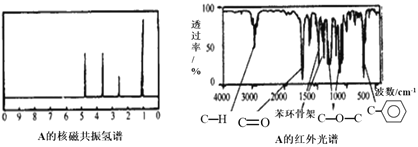
请回答下列问题:
(1)A的实验式为__________;
(2)A的结构简式为__________;
(3)该物质属于哪一类有机物____________;
(4)1molA在一定条件下可与___________molH2发生加成反应;
(5)A有多种同分异构体,同时满足下列条件的同分异构体M有______种。①属于芳香族化合物;②属于酯类;③分子结构中含有一个甲基。
查看答案和解析>>
科目: 来源: 题型:
【题目】分析下列有机化合物,完成填空。
① C2H4 ② C2H2 ③ ![]() ④
④![]()
⑤ ![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧  ⑨反-2-丁烯
⑨反-2-丁烯
(1)①~⑨中,属于苯的同系物的是____(填序号,下同);
(2)②的电子式为___________;
(3)④的系统命名为 ___________;
(4)⑨的结构简式为 __________;
(5)③被酸性KMnO4溶液氧化的有机产物的结构简式为_____和__________;
(6)⑧在核磁共振氢谱中有_______组峰;
(7)①、 ③、 ⑨的沸点由高到低的顺序是____________;
(8)写出⑤的含有苯环且与⑤不同类别的一种同分异构体的结构简式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】回收利用硫和氮的氧化物是环境保护的重要举措。
(1)已知:2NO(g ) + O2(g)![]() 2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
第一步:2NO(g ) ![]() N2O2(g) △H1 =-a kJmolˉ1 (快反应)
N2O2(g) △H1 =-a kJmolˉ1 (快反应)
第二步:N2O2(g ) + O2(g)![]() 2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
①下列对上述反应过程表述正确的是__________(填标号)。
A.NO比N2O2稳定
B.该化学反应的速率主要由第二步决定
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度为0时反应达到平衡
②该反应逆反应的活化能为_______________。
(2)通过下列反应可从燃煤烟气中回收硫。2CO(g) + 2SO2(g)![]() 2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:

①与实验a相比,实验b改变的实验条件可能是______________________。
②实验b中的平衡转化率a(SO2)=_________。
(3)用NH3消除NO污染的反应原理为: 4NH3 + 6NO![]() 5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
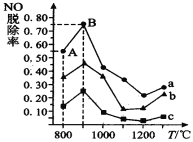
①曲线c对应NH3与NO 的物质的量之比是_______________。
②曲线a中 NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________ mg/(m3s)。
(4)双碱法除去SO2是指:用 NaOH 吸收SO2,并用CaO使 NaOH再生。NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
①用化学方程式表示NaOH 再生的原理____________________________________ 。
②25℃ 时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、 NaHSO3的混合溶液,且溶液恰好呈中性,则该混合溶液中各离子浓度由大到小的顺序为_____________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)。
查看答案和解析>>
科目: 来源: 题型:
【题目】废旧光盘金属层中含有金属Ag(其它金属微量忽略不计),从光盘中提取金属 Ag 的工艺流程如下。请回答下列问题。
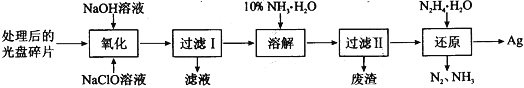
(1)“氧化”阶段需在 80 ℃ 条件下进行,使用的加热方式为______________________。
(2)NaClO溶液与Ag 反应的产物为AgCl、NaOH 和O2,该反应的化学方程式为____________。有人提出用HNO3代替 NaClO氧化Ag,从反应产物的角度分析,其缺点是______________。
(3)“过滤Ⅰ”中洗涤难溶物的实验操作为_____________________________________。
(4)常用10%的氨水溶解AgCl固体, AgCl与 NH3H2O按 1:2 反应可生成 Cl-和一种阳离子_____(填阳离子的化学式)的溶液。实际反应中,即使氨水过量,“废渣”中也含有少量AgCl固体,可能的原因是__________________________________________。
(5)理论上消耗 0.1 mol N2H4H2O可“还原”得到_____ g Ag的单质。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.氯酸钾和浓盐酸之间有下列反应:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O.
(1)该反应中发生还原反应的物质是________。氧化产物是________。
(2)用双线桥标出方程式中的电子得失2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O________
(3)当有0.2 mol电子发生转移时,生成的氯气的体积为________L (标准状况)。被氧化的HCl的物质的量为________mol.
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+) ③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
Ⅱ.已知反应:Cu+HNO3(稀)——Cu(NO3)2+NO↑+H2O;
(1)配平并用“双线桥法”表示上述反应中电子转移的方向和数目:___Cu+___HNO3(稀) = ___Cu(NO3)2+___NO↑+___H2O。___________
(2)该反应中氧化剂与还原剂的物质的量之比为_______;写出该反应的离子方程式______________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料](NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
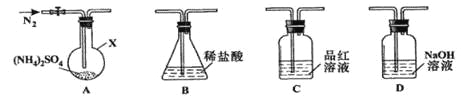
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________________;
(2)滴定前,下列操作的正确顺序是_________(填字母编号);
a.盛装0.2000mol/L NaOH溶液
b.用0.2000mol/L NaOH溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol,
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________;
(5)装置B内溶液吸收的气体是____________;
(6)(NH4)2SO4在400℃分解的化学方程式是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中![]() 变化的曲线如图所示。
变化的曲线如图所示。
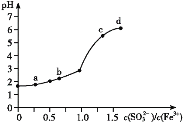
实验发现:
ⅰ.a点溶液澄清透明,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色;
ⅱ.c点和d点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色。
下列分析合理的是
A.向a点溶液中滴加BaCl2溶液,无明显现象
B.b点较a点溶液pH升高的主要原因:2Fe3++SO32-+H2O2Fe2++SO42-+2H+
C.c点溶液中发生的主要反应:2Fe3++3 SO32-+6H2O![]() 2Fe(OH)3+3H2SO3
2Fe(OH)3+3H2SO3
D.向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深
查看答案和解析>>
科目: 来源: 题型:
【题目】酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):

下列说法正确的是
A. B能和Br2的CCl4溶液发生加成反应,最多得到2种不同的有机产物
B. A发生加成反应生成B
C. 1 mol G完全燃烧生成7 mol H2O
D. H含有2种官能团
查看答案和解析>>
科目: 来源: 题型:
【题目】国际计量大会第26 届会议新修订了阿伏加德罗常数(NA=6.02214076×1023 mol―1), 并将于2019 年 5月20 日正式生效。下列说法中正确的是
A. 在 1 mol![]() 中,含有的中子数为 6 NA
中,含有的中子数为 6 NA
B. 将7.1 g C12溶于水制成饱和氯水,转移的电子数为 0.1 NA
C. 标准状况下,11.2 L NO和11. 2 L O2混合后,气体的分子总数为 0.75 NA
D. 某温度下,1L pH= 3的醋酸溶液稀释到10L 时,溶液中 H+的数目大于0.01 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,由甲烷、甲醛(HCHO)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
A. 20%B. 40%C. 60%D. 80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com