
科目: 来源: 题型:
【题目】某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按如图所示步骤进行提纯(过滤操作已略去)。下列说法不正确的是( )

A.起始滤液常温下pH>7
B.试剂Ⅰ为BaCl2溶液
C.该提纯过程中必须经2次过滤
D.步骤③目的是除去CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯碳酸锰在电子工业中有着重要的应用,湿法浸出软锰矿(主要成分为MnO2,含有少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的流程如下:其中除杂过程包括:①向浸出液中加入一定量的试剂X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是(已知室温下:Kap[Mg(OH)2]=1.8×10-11,Kap[Al(OH)3]=3.0×10-34,Kap[Fe(OH)3]=4.0×10-38。)
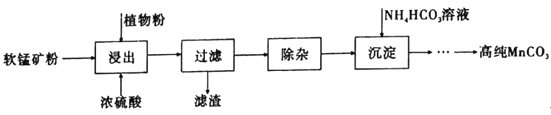
A.浸出时加入植物粉的作用是作为还原剂
B.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
C.试剂X可以是MnO、MnO2、MnCO3等物质
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用图示装置制备高铁酸钾(K2FeO4)并探究其性质。已知:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。制取实验完成后,取C中紫色溶液,加入稀盐酸,产生气体。下列说法不正确的是
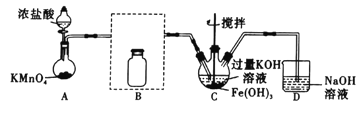
A.B瓶应盛放饱和食盐水除去混有的HCl
B.C瓶中KOH过量更有利于高铁酸钾的生成
C.加盐酸产生气体可说明氧化性:K2FeO4>Cl2
D.高铁酸钾是集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等八大特点为一体的优良的水处理剂
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在质量分数为28%的KOH水溶液中,OH-与H2O数目之比是________。
(2)由硫酸钾、硫酸铁和硫酸组成的混合溶液,其中c(H+)=0.1 mol/L,c(Fe3+)=0.3 mol/L,c(SO42-)=0.6 mol/L,则c(K+)为________。
(3)相同物质的量浓度的氯化钠、氯化镁、氯化铝溶液,分别与硝酸银溶液反应,当生成沉淀的质量之比为3∶2∶1时,消耗三种盐溶液的体积比为________。
(4)某状况下a L氨气(此时气体摩尔体积为Vm)溶解在一定量的水中形成b mL氨水溶液,所得溶液的密度为ρ g/mL,则该氨水的物质的量浓度可表示为________ mol/L;氨水的质量分数为________。
(5)已知1.505×1023个X气体分子的质量是8 g,则X气体的摩尔质量是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某科研团队研究将磷钨酸(H3PW12O40,以下简称HPW)代替浓硫酸作为酯化反应的催化剂,但HPW自身存在比表面积小、易溶于有机溶剂而难以重复使用等缺点,将其负载在多孔载体(如硅藻土、C等)上则能有效克服以上不足,提高其催化活性。用HPW负载在硅藻土上催化制取乙酸正丁酯的酯化率与HPW负载量的关系(温度:120℃,时间:2h)如图所示,下列说法不正确的是
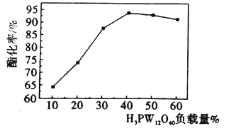
A.与HPW相比,HPW/硅藻土比表面积显著增加,有助于提高其催化性能
B.当HPW负载量为40%时达到饱和,酯化率最高
C.用HPW/硅藻土代替传统催化剂,可减少设备腐蚀等不足
D.不同催化剂对酯化率的影响程度主要取决于化学反应正向进行的程度
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学要配制100 mL 0.100molL﹣1Na2CO3溶液。下图是一些关键步骤和操作。
A. B.
B.![]() C.
C.
D.  E.
E.  F.
F. 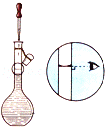
(1)配制过程的先后顺序为(用字母A~F填写)_______。
(2)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、_______。
(3)用Na2CO310H2O来配制溶液,若晶体已经部分失去结晶水,则所配得溶液的浓度会___(填“偏高”、“偏低”、“不变”)。
(4)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将__(填“偏高”、“偏低”、“不变”);步骤F称为___,如果俯视刻度线,配得溶液的浓度将___(填“偏高”、“偏低”、“不变”)。
(5)在步骤B之后,需_____才进行下一步操作。(Na2CO310H2O溶于水放热)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,在一个密闭的玻璃管两端各放一团棉花,再用注射器同时在两端注入适量的浓氨水和浓盐酸,下列说法不正确的是

A.玻璃管中发生的反应可表示为:NH3+HCl=NH4Cl
B.实验时会在玻璃管的A处附近看到白雾
C.用手触摸玻璃管外壁,会感觉到有热量放出
D.将浓盐酸换成浓硝酸也会有相似现象
查看答案和解析>>
科目: 来源: 题型:
【题目】H2与碱金属等单质在较高温度下可以化合形成离子型金属氢化物,如NaH、LiH等,它们具有极强的还原性,也是良好的野外生氢剂(NaH+H2O=NaOH+H2↑),下列说法不正确的是
A.金属氢化物具有强还原性的原因是其中的氢元素为-l价
B.NaH的电子式可表示为Na+[:H]-
C.NaAlH4与水反应:NaAlH4+H2O=NaOH+Al(OH)3+H2↑
D.工业上用有效氢含量衡量含氢还原剂的供氢能力,有效氢指单位质量(克)的含氢还原剂的还原能力相当于多少克氢气的还原能力。则LiAlH4的有效氢含量约为0.21
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含NaCl、MgCl2和Na2SO4的混合溶液,某兴趣小组的同学欲提取纯净的NaCl晶体,设计了如下实验:

请回答下列问题:
(1)写出沉淀Ⅰ和沉淀Ⅱ所含物质的化学式。沉淀Ⅰ:_________、沉淀Ⅱ:_______。
(2)上述流程中,加入过量稀盐酸的目的是______________。
(3)操作Ⅲ中需使用的玻璃仪器是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:


I II
(1)写出上述图中仪器的名称:①_______;②______;
(2)若利用装置I分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有__________,将仪器补充完整后进行的实验操作的名称为_____;实验时仪器②中冷却水的进口为_______(选填“f”或“g”)。
(3)现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置II是某同学转移溶液的示意图,图中有两处错误分别是_______,_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com