
科目: 来源: 题型:
【题目】制取Na2CO3和高纯Si的工艺流程如图所示,下列说法错误的是
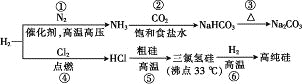
A. 反应①属于固氮反应
B. 步骤②为先向饱和食盐水中通入CO2至饱和后,再通入NH3
C. 反应⑤、⑥均为氧化还原反应
D. 用精馏的方法可提纯三氯氢硅
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
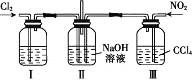
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
科目: 来源: 题型:
【题目】.A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及他物质已经略去);![]()
Ⅰ. 若A是一种黄色固体单质;B为酸雨的成因之一,且可使品红溶液褪色,回答以下问题:
(1)将B通入KMnO4溶液的现象为__________________________,体现B的_____________(选填 “氧化性”“还原性”“漂白性”)
(2)98%的浓硫酸改为氧化物形式SO3·nH2O,则n值为_________(可写成分数形式)
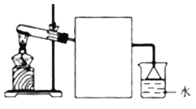
Ⅱ.若A气体可使湿润的红色石蕊试纸变蓝,则回答下列问题
(1)写出写出A→B的化学方程式_____________________________________________。
(2)实验室常用右图所示装置制取并收集A气体,请在框中画出实验室收集A气体的装置图________。
(3)尾气处理装置中使用倒扣漏斗的作用是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由2种常见元素组成的化合物G,有关转化和实验信息如下:

请回答下列问题:
(1)G是______________(填化学式)。
(2)写出A→B的离子方程式_____________________________________________。
(3)若D为纯净物,F是红色金属单质,写出D和稀硫酸反应的离子方程式_____________。
(4)C的最大质量为________________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的原因的是
A. 铜久置空气中表面出现绿色固体:2Cu+O2+CO2+H2O═Cu2(OH)2CO3
B. 某种火箭发射阶段有少量N2O4,逸出,产生红色气体:N2O4![]() 2NO2
2NO2
C. FeSO4·7H2O在空气中久置变黄:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
D. SO2通入KMnO4溶液中,溶液紫色逐渐褪去:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4十2H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A.3g由CO2和SO2组成的混合气体中含有的质子数为1.5NA
B.1L0.1molL-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C.0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D.2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 
B. 
C. 
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】公元八世纪,Jabir ibn Hayyan在干馏硝石的过程中首次发现并制得硝酸(4KNO3![]() 2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
A. 干馏产生的混合气体理论上可被水完全吸收
B. 王水是由3体积浓硝酸与1体积浓盐酸配制而成的
C. 王水溶解金时,其中的盐酸作氧化剂(Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O)
D. 实验室可用NaNO3与浓硫酸反应制备少量的HNO3,利用的是浓硫酸的氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.课堂上,老师提问如何鉴别浓硫酸与稀硫酸,某学习小组设计方案如下
方案 | 结论 | |
① | 往酸中投入火柴梗 | 变黑者为浓硫酸 |
② | 加入铝片 | 产生刺激性气味者为浓硫酸 |
② | 加少量酸于盛水的小烧杯中 | 放热者为浓硫酸 |
④ | 用玻璃棒蘸浓氨水靠近酸的瓶口 | 冒白烟者为浓硫酸 |
⑤ | 将酸滴加到胆矾晶体上 | 变白者为浓硫酸 |
(1)以上方案中,可行的是______________(填序号)
(2)其中一个稍作改进就能成为可行方案是________________,改进方法为____________。
(3)完全错误的是__________,因为_________________________________________。
Ⅱ.实验室用浓硫酸配制1.0mol/L硫酸溶液480mL,回答下列问题:
(1)如下图所示的仪器中配制溶液肯定不需要的是____________(填字母),配制上述溶液还需要用到的玻璃仪器是_________________________(填仪器名称)。

(2)容量瓶上标有以下5项中的_____________(填序号)
①压强 ②温度 ③容量 ④浓度 ⑤刻度线
(3)在配制过程中,下列操作使所配溶液浓度偏大的是______________(填序号)。
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
③定容时,仰视刻度线
④使用容量瓶前用蒸馏水洗涤且没干燥
(4)计算实验室配制上述溶液需用量筒取质量分数为98%、密度为1.84g/mL的浓硫酸的体积为_____________________mL。(保留小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com