
科目: 来源: 题型:
【题目】科学家研制出一种高性能水系酸碱双液锌一溴二次电池,其总反应为:Zn+2OH-+Br3-![]() ZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是( )
ZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是( )
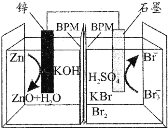
A.放电时,K+向石墨电极迁移
B.放电时,锌电极的电势高于石墨电极
C.充电时,阴极室的pH减小
D.充电时,石墨电极发生反应:Br3--2e-=3Br-
查看答案和解析>>
科目: 来源: 题型:
【题目】一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是( )
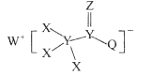
A.WX是共价化合物
B.原子半径:W>Z>Y
C.最高价氧化物对应的水化物的酸性:Q<Y
D.Z和X、Y、W、Q均形成至少两种二元化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】将CO2气体缓缓通入到含有等物质的量的KOH、Ba(OH)2和KAlO2的混合溶液中,直至过量,生成的沉淀的物质的量与所通CO2的体积关系如图所示(假设每步反应均完全)。下列关于整个反应进程中的各种描述不正确的是
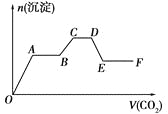
A.A→B段与C→D段所发生的反应相同
B.B→C段反应的离子方程式是:2AlO2―+3H2O+CO2=2Al(OH)3↓+CO32―
C.O→A段反应的化学方程式是:Ba(OH)2+CO2=BaCO3↓+H2O
D.D→E段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组在20℃,101KPa下探究Cl2在蒸馏水和饱和食盐水中的溶解性。如图I、II所示,该小组用两支100mL注射器均吸入40mLCl2,然后分别吸入20mL蒸馏水和饱和食盐水,夹紧止水夹,充分振荡。下列说法正确的是( )
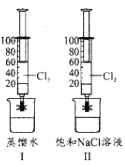
A.图I注射器中c(Cl-)约为0.09molL-1
B.图l注射器中n(ClO-)小于图II
C.图II注射器的活塞移动到20mL刻度处
D.图II注射器中存在NaCl(s)![]() Na+(aq)+Cl-(aq)
Na+(aq)+Cl-(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
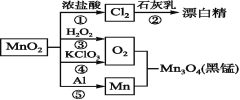
A.反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D.反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
科目: 来源: 题型:
【题目】钼和钒在炼钢、有机化工、高科技等领域有广泛应用。一种从炼油工业的废催化剂(主要成分为V2O5、MoO3、Al2O3、硫化物和碳氢化合物)中回收钼、钒的工艺流程如图:
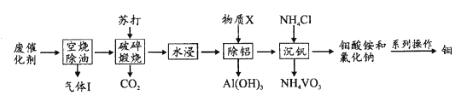
(1)“气体”除CO2、H2O外,还含有的主要成分是____。
(2)“破碎”的目的是____;缎烧中V2O5转化的化学方程式是____。
(3)加人物质X的目的是调节溶液pH除铝,X的化学式是____。
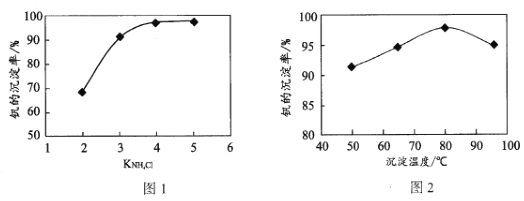
(4)“沉钒”过程中控制pH为8.35,其他条件一定时,钒的沉淀率与加铵系数KNH4Cl、温度的关系分别如图1、图2,则应选择的加铵系数是____;温度超过80°C时,钒的沉淀率下降的原因是____。
(5)钼酸铵[(NH4)2MoO4]在高温下通入H2可制得单质钼,该过程的化学方程式是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】将ag某物质在足量氧气中充分燃烧再将气体生成物通入足量的Na2O2充分反应,固体增重为bg,若a<b,则该物质可能是( )
A. H2B. COC. 乙酸(CH3COOH)D. 甲烷(CH4)
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4xH2O)在电池工业、制药、照片显影等方面有重要作用。在实验室中用制备草酸亚铁并研究其性质,具体流程如图:

已知:常温下,pH>4时,Fe2+容易被氧化;H2C2O4的Ka1=5.9×10-2,Ka2=6.5×10-5;Ksp(FeC2O4xH2O)=3.2×10-7
回答下列问题:
(1)步骤①用水溶解的过程中,加入少量稀H2SO4的作用是_____。
(2)步骤②中加入的H2C2O4属于_____酸,生成固体I的离子反应方程式为_____。
(3)步骤③中先用水洗涤,再用乙醇洗涤,其目的是_____。
(4)步骤④是检验草酸亚铁晶体加热分解后的产物H2O、CO、CO2,首先检验的气体为_____,然后将剩余气体依次通过_____(填序号,装置可重复使用)→尾气处理。实验前需要将装置中的空气排尽,理由是_____。

(5)步骤⑤采用滴定分析法测定FeC2O4xH2O中x的值。取0.18g样品溶于稀硫酸配成100.00mL溶液,取20.00mL于锥形瓶中,用0.0100molL-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00mL。滴定终点的现象为_____,x值为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠、碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____。
(2)在钠、碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 1∶91 |
pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显___性,用化学平衡原理解释:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com