
科目: 来源: 题型:
【题目】通过对阳极泥的综合处理可以回收贵重的金属,一种从铜阳极泥(主要成分为Se、Ag2Se、Ag、Cu、CuSO4和Cu2S等)中分离Ag、Se和Cu的新工艺流程如图所示:
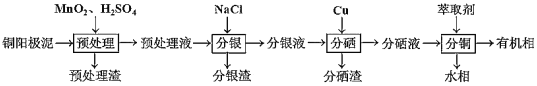
(1)已知预处理温度为80℃,预处理渣中几乎不含S元素,预处理时Cu2S发生反应的离子方程式为___,比起传统工艺中采用浓硫酸作氧化剂,本工艺中采用稀H2SO4溶液添加MnO2做预处理剂的主要优点是___。
(2)回收分渣中的银,可用如下过程:
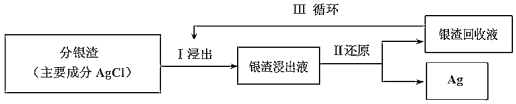
已知:S2O32-在碱性条件下很稳定,易与银离子络合:Ag++2S2O32-![]() Ag(S2O3)23-。常温下,络合反应的平衡常数为K稳[Ag(S2O3)23-]=2.8×1013,Ksp(AgCl)=1.8×10-10。
Ag(S2O3)23-。常温下,络合反应的平衡常数为K稳[Ag(S2O3)23-]=2.8×1013,Ksp(AgCl)=1.8×10-10。
①Ⅰ中发生的离子反应方程式为:AgCl(s)+2S2O32-(aq)![]() Ag(S2O3)23-(aq)+Cl-(aq),常温下此反应的平衡常数K为___(结果保留二位小数)。
Ag(S2O3)23-(aq)+Cl-(aq),常温下此反应的平衡常数K为___(结果保留二位小数)。
②Ⅱ中还原剂为Na2S2O4,在碱性条件下进行反应生成Na2SO3,相应的离子反应方程式为:2Ag(S2O3)23-+S2O42-+4OH-=2Ag+4S2O32-+2SO32-+2H2O,所以Ⅲ中的银渣回收液可直接循环使用,但循环多次后银的浸出率会降低,请从化学平衡移动的角度分析原因___。
(3)分硒渣的主要成分是Cu2Se,可被氧化得到亚硒酸(H2SeO3)。
①已知常温下H2SeO3的Ka1=2.7×10-3,Ka2=2.5×10-4,则NaHSeO3溶液的pH__7(填“>”、“<”或“=”)。
②二元强酸硒酸(H2SeO4)可以用电解亚硒酸溶液的方法制得,电解时的阳极反应式为___。
(4)分铜得到产品CuSO45H2O的具体操作如下:
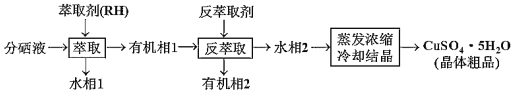
①萃取与反萃取原理为:2RH+Cu2+![]() R2Cu+2H+,反萃取剂最好选用__(填化学式)溶液。
R2Cu+2H+,反萃取剂最好选用__(填化学式)溶液。
②蒸发浓缩需用小火加热至溶液表面出现__为止,再冷却结晶即可得到产品CuSO45H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】由SO2和O2制备SO3(熔点16.8℃,沸点44.8℃)的模拟装置如下图所示)(加热和夹持装置省略):

下列说法正确的是
A. 装置①中的试剂为饱和NaHSO3溶液
B. 实验室可用铜与稀硫酸在加热条件下制取SO2
C. 裝置③反应管中的铂石棉用作反应的催化剂
D. 从装置⑤逸出的气体有过量的SO2和O2
查看答案和解析>>
科目: 来源: 题型:
【题目】喹啉是合成药物的中间体,一种合成喹啉的路线如图:

(1)A→B所需的试剂为_____。
(2)两分子B在一定条件下生成C和乙醇,化合物B断键的位置为_____(填序号)
(3)C→D的反应类型为_____,D→E的反应方程式是_____。
(4)化合物G中,除亚氨基外还含有的官能团名称是_____。
(5)F的同分异构体W能与碳酸氢钠溶液反应放出气体,且能使溴水褪色,其中核磁共振氢谱峰面积比为6:1:1。W的结构简式为_____。
(6)参照上述路线,设计以苯胺(![]() )和
)和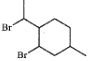 制备的
制备的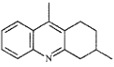 合成路线(无机试剂任选)_____。
合成路线(无机试剂任选)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知异丁烷的分子结构可简写成键线式结构为![]() 。有机物X的键线式结构为
。有机物X的键线式结构为![]() ,有机物Y与等物质的量的H2发生加成反应可得到有机物X。下列有关说法错误的是( )
,有机物Y与等物质的量的H2发生加成反应可得到有机物X。下列有关说法错误的是( )
A. 有机物X的一氯代物只有4种
B. 用系统命名法命名有机物X名称为2,2,3-三甲基戊烷
C. 有机物X的分子式为C8H18
D. Y的结构可能有3种,其中一种名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,15g甲基(-CH3)所含的电子数为10NA
B. 常温常压,11.2L氦气中含有的原子数为0.5NA
C. 标准状况下,4.48L重水(D2O)中含有的中子数为2NA
D. 常温常压下,23gNO2和N2O4的混合物中含有NA个氧原子
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是

A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中一定不含CO32-和SO42-,可能含有Cl-
C.溶液中n(Mg2+)=0.1mol
D.n(H+) :n(NH4+) : n(Al3+) : n(Mg2+)=2:4:2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
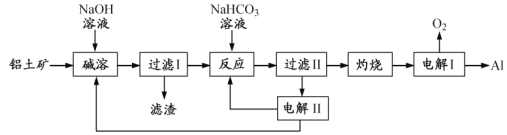
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
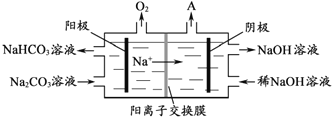
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu2S是火法炼铜的重要原料之一,如图是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图。
Cu2S![]() Cu
Cu![]() Cu2O、CuO
Cu2O、CuO![]() A
A![]() B
B![]() 胆矾
胆矾
(1)Cu2S中铜元素的化合价为___,火法炼铜的反应原理是__________(用化学方程式表示)。
(2)向Cu2O、CuO中加入足量稀硫酸得到的体系A中溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式____________。
(3)若将A中红色物质反应掉,操作Ⅰ中加入的试剂最好是___(填字母序号)。
A.适量的NaNO3
B.适量的HNO3
C.适量的H2O2
(4)若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH由2变为1(体积变化忽略不计),此时电解过程中转移电子的物质的量是_____。
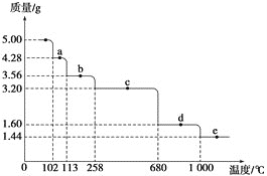
(5)取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如图所示。通过计算确定258℃时发生反应的化学方程式:____,e点对应物质的化学式为_____(计算过程略去)。
查看答案和解析>>
科目: 来源: 题型:
【题目】绪(Ge)是半导体元素,应用广泛,回答下列问题:
(1)下列为Ge价电子层电子排布图表示的状态中,能量最低和最高的分别为____、_____(填选项)。
A.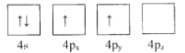 B.
B.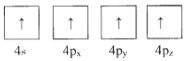
C.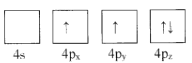 D.
D.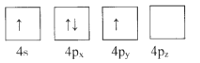
(2)GeH4的空间构型为____;比较与同锗族的氢化物的沸点如表所示,分析其变化规律及原因____。
CH4 | SiH4 | GeH4 | |
沸点/℃ | -161.5 | -119 | -88.1 |
(3)有机锗化合物A有一定的医疗保健作用,其结构简式为CF3N=GeH2,则Ge的杂化形式为____,碳原子与其它原子结合的键的种类为_____。
(4)Li2GeF6可以作为锂电池的电解质,则Li、Ge、F电负性由大到小的顺序为_____。
(5)Ge晶胞如下,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() ),D为(
),D为(![]() ,
,![]() ,
,![]() )。则C原子的坐标参数为_____。
)。则C原子的坐标参数为_____。
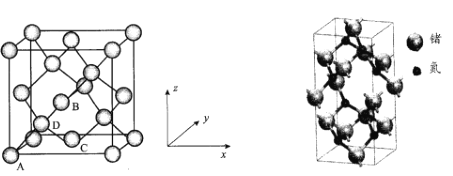
(6)氮化锗具有耐腐蚀、硬度高等优点,晶体中锗原子与氮原子之间存在明显的s-p杂化现象,氮化锗晶体属于____晶体。一种氮化锗晶胞的球棍模型如图,晶体中n(Ge)/n(N)=____,若晶胞底面正方形的边长为anm,阿伏加德罗常数值为NA,晶体的密度为ρg/cm3,则长方体的高为____nm(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2加氢可转化为高附加值的CO、CH4、CH3OH等C1产物。该过程可缓解CO2带来的环境压力,同时可变废为宝,带来巨大的经济效益。CO2加氢过程,主要发生的三个竞争反应为:
反应i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.01kJmol-1
CH3OH(g)+H2O(g)△H=-49.01kJmol-1
反应ii:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H=-165.0kJmol-1
CH4(g)+2H2O(g)△H=-165.0kJmol-1
反应iii:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.17kJmol-1
CO(g)+H2O(g)△H=+41.17kJmol-1
回答下列问题:
(1)由CO、H2合成甲醇的热化学方程式为_____。
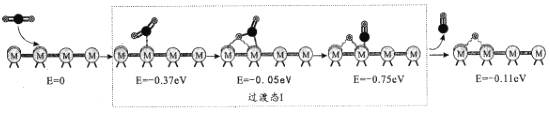
(2)反应iii为逆水煤气变换反应,简称RWGS。以金属催化剂为例,该反应历程的微观示意和相对能量(eV)变化图如图所示(![]() 为催化剂,
为催化剂,![]() 为C原子,
为C原子,![]() 为O原子,o为H原子)
为O原子,o为H原子)
历程I:
历程II:

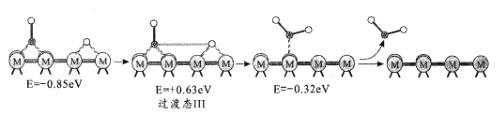
历程III:
①历程1方框内反应的方程式为CO2*+*=CO*+O*(*为催化剂活性位点)。根据图示,其反应热△H_____0(填“>”或“<”)。
②反应历程II方框内的方程式是_____。
③反应历程中_____(填“历程I”、“历程II”或“历程III”)是RWGS的控速步骤。
(3)我国科学家研究了不同反应温度对含碳产组成的影响。在反应器中按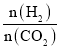 =3:1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
=3:1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):

①1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_____、_____。M点CO平衡组成含量高于N点的原因是_____。
②当CH4和CO平衡组成为40%时,该温度下反应iii的平衡常数Kp为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com