
科目: 来源: 题型:
【题目】常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )
A. 由水电离产生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I-
B. c(H+)=![]() mol/L的溶液中:K+、Fe3+、Cl-、CO32—
mol/L的溶液中:K+、Fe3+、Cl-、CO32—
C. 常温下,![]() =1×10-12的溶液:K+、AlO2—、CO32—、Na+
=1×10-12的溶液:K+、AlO2—、CO32—、Na+
D. pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 冰镇的啤酒打开后泛起泡沫
B. 对N2+3H2![]() 2NH3的反应,使用铁触媒可加快合成氨反应的速率
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目: 来源: 题型:
【题目】腈亚胺与邻酚羟基苄醇在碱的作用下可以发生偶联反应生成醚键,反应的条件温和,操作简单,目标产物收率高。下面是利用该方法合成化合物H的一种方法:
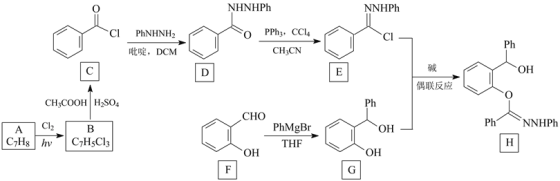
注:以上合成路线中,Ph代表苯基,如PhNHNH2表示![]() 。
。
实验 | 碱 | 温度/℃ | 溶剂 | 产率% |
1 | Et3N | 25 | DCM | <10 |
2 | 吡啶 | 25 | DCM | <5 |
3 | Cs2CO3 | 25 | DCM | 70 |
4 | LiOtBu | 25 | DCM | 43 |
5 | Cs2CO3 | 25 | DMF | 79 |
6 | Cs2CO3 | 25 | CH3CN | 83 |
回答下列问题:
(1)A的化学名称为_________,B的结构简式为___________。
(2)由C生成D的反应类型是________,F中的官能团名称是___________。
(3)H的分子式为_______________。
(4)不同条件对偶联反应生成H产率的影响如上表:
观察上表可知,当选用DCM作溶剂时,最适宜的碱是____________,由实验3、实验4和实验5可得出的结论是:25℃时,____________________,H产率最高。
(5)X为G的同分异构体,写出满足下列条件的X的结构简式:____________。
①所含苯环个数与G相同;②有四种不同化学环境的氢,其个数比为1:1:2:2
(6)利用偶联反应,以![]() 和化合物D为原料制备
和化合物D为原料制备 ,
,
写出合成路线:____________________________。(其他试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是
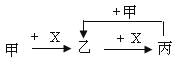
A.C和O2B.SO2 和NaOH溶液
C.Cl2和FeD.AlCl3溶液和NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
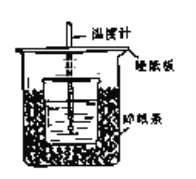
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________;由图可知该装置有不妥之处,应如何改正?___________________________________________________.
(2)烧杯间填满碎塑料泡沫的作用是__________________________________________.
(3)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求得的中和热数值___________(填“相等、不相等”)
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会____________(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
FeS2 ![]() SO2
SO2 ![]() SO3
SO3 ![]() H2SO4
H2SO4
回答下列问题:
(1)基态V原子的电子排布式为________,基态Fe原子核外未成对电子数为______。
(2)组成H2SO4的元素中,电负性由大到小的顺序是________,SO2分子的VSEPR模型为________。
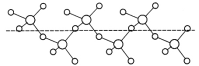
(3)固态SO3能以无限长链形式存在(如图所示)。其中S原子的杂化形式为______。长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是________(填“桥氧”或“端基氧”),原因是______________。
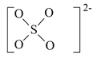
(4)绿矾是一种重要的硫酸盐,其组成可写成[Fe(H2O)6]2+[SO4(H2O)]2-,水合阴离子中H2O通过氢键与SO42-中的O原子相联结,按图示画出含氢键的水合阴离子:______________。
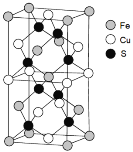
(5)一种含Fe、Cu、S三种元素的矿物晶胞如图所示,属于四方晶系(晶胞底面为正方形)。S2-的配位数为______。若晶胞的底面边长为a pm,高为b pm,晶体密度为ρ g/cm3,则阿伏加德罗常数可表示为____________(写出表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol NH4+中含有的电子数为11 NA
B.0.1mol·L-1的Ba(OH)2溶液中含有的OH- 数目为0.2NA
C.0.1NA个氯分子溶于1L水中,所得溶液中c(C1-)=0.1mol·L-1
D.1mol NH3溶于水中配成1L溶液,所得氨水的物质的量浓度为1mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】将硫酸铜的稀溶液放在密闭容器中,缓缓抽去容器中的水蒸气,溶液逐渐失水变成饱和溶液,再继续抽气,则变成各种含水盐,最后变成无水硫酸铜。50℃时,容器中的压强与晶体水合物中含水量的关系如图所示,下列说法错误的是
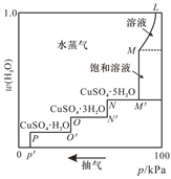
A.曲线L-M对应溶液中无硫酸铜晶体析出
B.曲线M-M对应溶液溶质的质量分数保持不变
C.曲线M- N对应体系存在平衡:CuSO4(饱和溶液)![]() CuSO4·5H2O(s)+H2O(g)
CuSO4·5H2O(s)+H2O(g)
D.当容器中压强低于p后得到无水硫酸铜
查看答案和解析>>
科目: 来源: 题型:
【题目】I.(1) SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l)。已知室温下2 g SiH4自燃放出的热量为89.2 kJ,则其热化学方程式为: _____________________。
(2)沼气是一种能源,它的主要成分是CH4,其燃烧的热化学方程式为:CH4(g)+2O2(g) = CO2(g)+2H2O(l ) ΔH=-890 kJ/mol,又已知H2O(l)=H2O(g) ΔH=+44 kJ/mol,则11.2 L(标准状况)CH4完全燃烧生成气态水时放出的热量为_______________。
Ⅱ.已知下列几种烷烃的燃烧热如下:
烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
燃烧热/ (kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 | 4163.1 |
今有10 L(标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480 kJ。
(1)试写出乙烷气体燃烧的热化学方程式___________________________________。
(2)计算该天然气中甲烷的体积分数____________(保留小数点后两位)。
(3)由上表可总结出的近似规律是______________________________________________。
(4)根据(3)的近似规律可预测癸烷的燃烧热约为______kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应.请回答下列问题:
(1)写出B、C、E元素的名称B___________、C__________、E_____________。
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为____________。
(3)不能验证C和F两种元素非金属性强弱的结论是(填编号)________。
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为________、________,这两种酸式盐相互反应的离子方程式为_______。
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为___________。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为________。
①a mol ②b mol ③ a/3mol ④ b/3mol ⑤0 ⑥(4a﹣b)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com