
科目: 来源: 题型:
【题目】若在一定条件下,容积恒定的反应室中充入amolCO与2amolH2,在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),下列措施一定使c(CH3OH)/c(CO)增大的是
CH3OH(g),下列措施一定使c(CH3OH)/c(CO)增大的是
A. 升高温度
B. 恒温恒容再充入a mol CO和2a mol H2
C. 恒温恒容再充入H2
D. 充入Ar(g)使体系的总压增大
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是
2SO3(g) ΔH<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是

A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目: 来源: 题型:
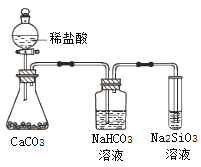
【题目】用下图装置进行下列实验,试管内试剂可按需要更换,实验不产生污染性气体且能成功的是 ( )

A.加热NaHCO3制CO2,并用澄清石灰水检验CO2
B.用Cu与浓硫酸反应制少量SO2,并检验SO2的漂白性
C.加热NH4Cl制NH3,并检验氨气溶于水后显碱性
D.用醋酸与乙醇、浓硫酸混合反应制乙酸乙酯,并观察生成的乙酸乙酯的状态、气味
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氧化还原反应的叙述中,正确的是( )
A.有单质参加的反应一定是氧化还原反应
B.燃烧反应必须有氧气作氧化剂
C.2Fe+3Cl2![]() 2FeCl3; Fe+S
2FeCl3; Fe+S![]() FeS 由此可以判断氧化性:Cl2>S
FeS 由此可以判断氧化性:Cl2>S
D.Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg
查看答案和解析>>
科目: 来源: 题型:
【题目】将3molA气体和1.5molB气体在3L的容器中混合并在一定条件发生如下反应: 2A(g)+B(g) ![]() 2C(g)。经2s后测得C的浓度为0.3mol/L,则下列计算正确的是:
2C(g)。经2s后测得C的浓度为0.3mol/L,则下列计算正确的是:
①用A表示的平均反应速率为0.3mol/(L·s)
②2s时物质A的浓度为0.7mol/L
③用B表示的平均反应速率为0.15mol/(L·s)
④2s时物质B的转化率为30%
A.②④B.①④C.②③D.①③
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,将xmL pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A. 若x=y,且a+b=14,则pH>7B. 若10x=y,且a+b=13,则pH=7
C. 若ax=by,且a+b=13,则pH=7D. 若x=10y,且a+b=14,则pH>7
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸分别加水稀释至平衡,pH随溶液体积变化的曲线如下图所 示。据图判断正确的是

A. Ⅱ为盐酸稀释时的pH变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目: 来源: 题型:
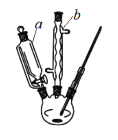
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目: 来源: 题型:
【题目】常用解热镇痛药对乙酰氨基苯酚(扑热息痛)为白色颗粒状晶体,易被空气氧化。实验室用对氨基苯酚乙酰化制备扑热息痛的一种方法如下:

查阅资料获得以下数据:
对氨基苯酚 | 醋酸酐 | 对乙酰氨基苯酚 | |
熔点/℃ | 189.6 ~ 190.2 | -73 | 169 ~ 171 |
密度/g·cm-3 | 1.2 | 1.1 | 1.3 |
相对分子质量 | 109 | 102 | 151 |
溶解性 | 溶于乙醇和水 | 溶于乙醇, 稍溶于水 | 易溶于乙醇和热水,溶于丙酮 |
实验过程:如图所示,在三颈烧瓶中加入对氨基苯酚10.9g,再加入30 mL水。打开仪器a下端的旋塞,缓慢滴加12 mL醋酸酐。搅拌并水浴加热,控制温度在80℃左右,充分反应后按如下流程进行操作。
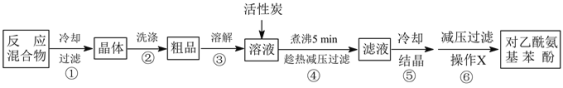
回答下列问题:
(1)仪器a的名称是___________,仪器b的作用是_____________。
(2)步骤②洗涤晶体获得粗品时,选择的洗涤剂是______。(填标号)
A.乙醇 B.丙酮 C.热水 D.冷水
(3)减压过滤装置如图所示。步骤④减压过滤时,在吸滤瓶中要先加入适量NaHSO3,其作用是_________,该减压过滤需趁热进行,原因是_____________。
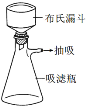
(4)步骤⑥中操作X为_______________。
(5)若最终得到9.8 g对乙酰氨基苯酚,则本实验的产率为______%。(保留1位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种常见的燃料,也是重要的基础化工原料。回答下列问题:
(1)采用甲醇气相氨化法可制得二甲胺。
已知:2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g) H1=-3122kJ/mol
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) H2=-472 kJ/mol
4(CH3)2NH(g)+15O2(g) 8CO2(g)+14H2O(g)+2N2(g) H3=-7492 kJ/mol
则制备二甲胺反应2CH3OH(g)+NH3(g) (CH3)2NH(g)+2H2O(g)的H=_____ kJ/mol。
(2)一定条件下,甲醇气相氨化法原料气中c(CH3OH):c(NH3)分别为1:1、2:1、3:1时,NH3的平衡转化率随温度变化的关系如图:
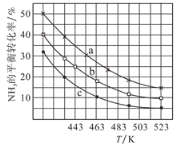
①代表原料气中c(CH3OH):c(NH3)=1:1的曲线是________。
②一定温度下,控制原料气中c(CH3OH):c(NH3)=3:1,能增大NH3平衡转化率的措施是_______。
③温度为443K时,按c(CH3OH):c(NH3)=2:1投料,若NH3的起始浓度为2mol/L,则反应达到平衡时,(CH3)2NH的体积分数为_______,该温度下的化学平衡常数为________ 。
(3)甲醇可通过电化学方法由甲烷直接制得,装置如下图所示,电解生成CH3OH的过程分为3步:

①通电时,氯离子先转化为高活性的原子氯(Cl·);
②Cl·与吸附在电极上的CH4反应生成HCl和CH3Cl;
③在碱性电解液中,CH3Cl转化为目标产物CH3OH。
步骤①的电极反应式为__________,步骤③的离子方程式为__________,维持电流强度为1.5A,装置工作2小时,理论上可制得CH3OH的质量为________g。(已知F=96500C/mol,不考虑气体溶解等因素)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com