
科目: 来源: 题型:
【题目】A~G各物质间的关系如下图,其中B、D为气态单质。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为__________________________;
若只能在加热情况下进行,则反应物A应为________;
(3)写出D转化为G的化学方程式_____________________________________;
(4)新配制的F溶液应加入________以防止其转化为G。检验G溶液中阳离子的常用试剂是________,实验现象为________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
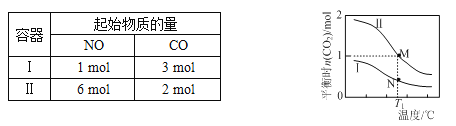
A. N点的平衡常数为0.04
B. M、N两点容器内的压强:P(M)>2P(N)
C. 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol·L-1
D. 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7%
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示转化关系中涉及到的物质均由主族元素组成(部分产物已略去),其中C、D为单质,A、B、E、F、G为化合物,除C与D的反应外,其它反应均在溶液中进行。请填写下列空白。
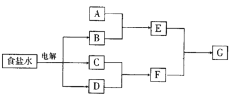
(1) 若A是常见的金属或金属氧化物,当F过量时,G为可溶性盐,则A的化学式为_________或_________。
(2) 若A是一种常见氧化物,不管F过量与否,G为同一种难溶性物质,则A的名称是________,晶体类型是_______,A的用途是_________。
(3) 若A是一种具有漂白性的气态氧化物,A是___;若A是一种无味的气态氧化物,A的电子式为______。
(4) 若A为有机化合物,如果A与G为同一物质,请写出两种A(不同类别物质)的结构简式:_____;_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】20℃时,在c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol·L-1的H2C2O4、NaOH混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )
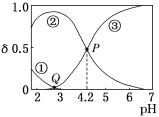
A. 0.100 mol·L-1NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
B. Q点:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
C. P点:c(Na+)+c(H2C2O4)<0.100mol·L-1+c(C2O42-)
D. 该温度下H2C2O4的电离常数Ka2=1×10-4.2
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学实验小组,为验证氯单质的氧化性强于硫和氮气,设计了一套实验装置:(部分夹持装置已略去)
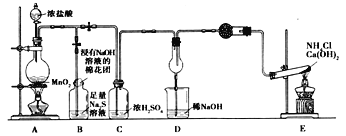
(1)写出A中反应的离子方程式_________。
(2)实验中证明氧化性Cl2>S的实验现象为___________。
(3)D干燥管中产生大量白烟,该反应的化学方程式为 ____________________。
(4)有同学认为从C排出的Cl2可能含有某杂质气体,影响D中现象的判断,该杂质气体是__________,若除去该杂质气体可以用___________溶液。
(5)E装置中反应的化学方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=12的X、Y两种碱溶液各10mL,分别稀释至1000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
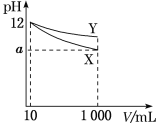
A. 若10<a<12,则X、Y都是弱碱
B. X、Y两种碱的物质的量浓度一定相等
C. 完全中和pH相同的X、Y两溶液时,消耗同浓度盐酸的体积:V(X)>V(Y)
D. 稀释后,X溶液的碱性比Y溶液的碱性强
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下面的信息,推断元素及有关物质,按要求回答问题:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。(1)根据信息①,X一定不是_________(填序号)。
A.氢 B. 碳 C. 氧 D. 硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素?______。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为___________。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)析出白色沉淀的离子方程式为__________________________。
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为___;Y在X的氧化物中能剧烈燃烧,其反应现象为__。
(6)已知H![]() 的燃烧热为285.8 kJ/mol。现有X的氢化物XH4和H2的混合气体各0.1mol,与O
的燃烧热为285.8 kJ/mol。现有X的氢化物XH4和H2的混合气体各0.1mol,与O![]() 完全燃烧生成H2O(1)时,放出的热量为117.6kJ。则XH4完全燃烧的热化学反应方程式为:________。
完全燃烧生成H2O(1)时,放出的热量为117.6kJ。则XH4完全燃烧的热化学反应方程式为:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究性学习小组为学习了元素性质后,分别设计了如下实验:
(1)甲同学想探究“铝热反应”中熔融物的成份,他查阅《化学手册》得到Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | …… |
①由此甲同学推测,教材中铝热反应所得到的熔融物应是铁铝合金。其理由是:_______________。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是___,反应的离子方程式为_____。
③甲同学为确定熔融物中是否还会有残留的Fe2O3,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确___(填“正确”或“不正确”),理由是(用离子方程式表示)______________________。
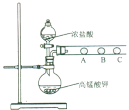
(2) 乙同学设计了如下图装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学可能观察到的现象有_______。 从环保角度考虑,该装置有明显不足,请提出改进建议_____________________。
(3) 丙同学欲比较N、C、Si的非金属性强弱,设计了下图所示的实验装置,其设计能否达到实验目的______(填“能”或“不能”),理由是______________。 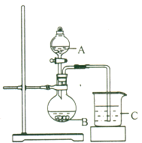
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成F,其合成路线如下图所示。
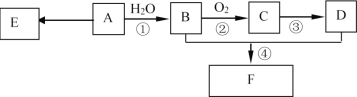
(1)A分子中官能团的名称是____________,D中官能团的名称是________反应①的反应类型是___________反应。
(2)反应②的化学方程式是___________________________。
反应④的化学方程式是___________________________。
(3)E是常见的高分子材料,合成E的化学方程式是_____________________________。
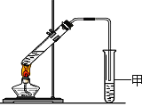
(4)某同学用如右图所示的实验装置制取少量F。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
① 实验开始时,试管甲中的导管不伸入液面下的原因是______________。
②上述实验中饱和碳酸钠溶液的作用是(填字母) ________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
③在实验室利用B和D制备F的实验中,若用1mol B和1mol D充分反应,__________(能/不能)生成1mol F,原因是 __________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
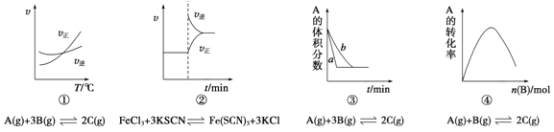
A. ①是其他条件一定时,反应速率随温度变化的图像,则正反应ΔH>0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C. ③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com