
科目: 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】反应2A(g)![]() 2Y(g) + E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2Y(g) + E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压B.减压C.减小E的浓度D.降温
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。

(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是_______(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是__________(填字母序号)。
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:
________NH4++ 5O2=2NO2-+ ________H++__________+__________
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg | 处理24 h | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是_____________,在最佳反应温度时,48 h内去除氨氮反应的平均速率是____________mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。右图是间接氧化工业废水中氨氮(NH4+)的示意图。

① 结合电极反应式简述间接氧化法去除氨氮的原理:_______________。
② 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将___________(填“增大”、“不变”或“减小”),请简述理由:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一。有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因:_______________。
(2)已知:0.1 mol·L-1KHC2O4溶液呈酸性。下列说法正确的是_______(填字母序号)。
a. 0.1 mol·L-1KHC2O4溶液中:c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol·L-1KHC2O4溶液中:c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. 浓度均为0.1 mol·L-1KHC2O4和K2C2O4的混合溶液中:2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+) > c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
![]()
已知:i. pH>4时,Fe2+易被氧气氧化
ii. 几种物质的溶解度(g /100g H2O)如下
FeSO4·7H2O | (NH4)2SO4 | FeSO4·(NH4)2SO4·6H2O | |
20℃ | 48 | 75 | 37 |
60℃ | 101 | 88 | 38 |
①用稀硫酸调溶液pH至1~2的目的是:_____________,______________。
②趁热过滤的原因是:_______________。
③氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取a g草酸亚铁晶体溶于稀硫酸中,用b mol·L-1的高锰酸钾标准液滴定,到达滴定终点时,消耗高锰酸钾VmL,则M =__________。(已知:部分反应产物为Mn2+、Fe3+、CO2)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 3Z(g)。此反应达到平衡的标志是
3Z(g)。此反应达到平衡的标志是
A. 容器内压强不随时间变化
B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为l∶2∶3
D. 单位时间消耗0.1 mol X同时生成0.3 mol Z
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲、乙、丙、丁四个烧杯中分别盛有100mL蒸馏水,然后分别放入等物质的量的Na、Na2O、Na2O2、NaOH,待固体完全溶解,则四个烧杯中溶液的质量分数的大小顺序为( )

A.甲<乙<丙<丁B.丁<甲<乙=丙C.甲=丁<乙=丙D.丁<甲<乙<丙
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )

A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】关于反应过程中的先后顺序,下列评价正确的是
A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式书写正确的
A.甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+ 2H2O(g)△H=-890 kJ/mol
B.在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H=-158.4kJ·mol-1
2SO3(g) △H=-158.4kJ·mol-1
C.NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1
D.2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4–和有机阳离子构成电解质溶液,其放电工作原理如下图所示。下列说法不正确的是
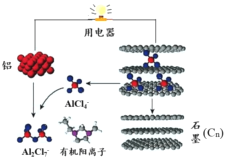
A.放电时,铝为负极、石墨为正极
B.放电时,有机阳离子向铝电极方向移动
C.放电时的负极反应为:Al –3e- + 7AlCl4– = 4Al2Cl7–
D.充电时的阳极反应为:Cn + AlCl4––e- = CnAlCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com