
科目: 来源: 题型:
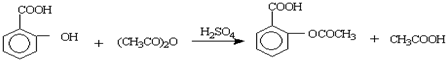
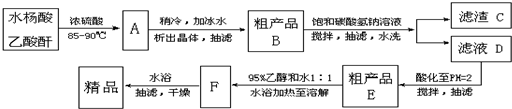
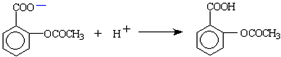
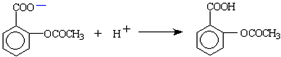
查看答案和解析>>
科目: 来源: 题型:阅读理解
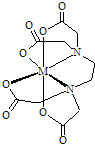 乙二胺四乙酸(EDTA)及其盐是常用于定量检测和分析金属离子的重要试剂.EDTA的阴离子可简写为Y4-,它与一些金属离子反应生成稳定的金属有机化合物离子:M2++Y4-=(MY)2-;M3++Y4-=(MY)-.
乙二胺四乙酸(EDTA)及其盐是常用于定量检测和分析金属离子的重要试剂.EDTA的阴离子可简写为Y4-,它与一些金属离子反应生成稳定的金属有机化合物离子:M2++Y4-=(MY)2-;M3++Y4-=(MY)-.| M2+ | K[(MY)2-] | Ksp(MS) | 填“是”或“否” |
| Pb2+ | 2×1018 | 4×10-26 | |
| Cd2+ | 2.6×1016 | 1×10-20 |
| C((CdY) 2-) |
| c(Cd2+)×c(Y4-) |
| 0.01-x |
| x×(0.49+x) |
| 0.01 |
| 0.49x |
| C((CdY) 2-) |
| c(Cd2+)×c(Y4-) |
| 0.01-x |
| x×(0.49+x) |
| 0.01 |
| 0.49x |
查看答案和解析>>
科目: 来源: 题型:
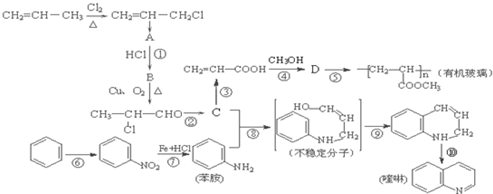
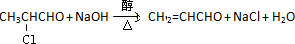
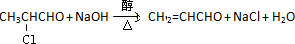


查看答案和解析>>
科目: 来源: 题型:
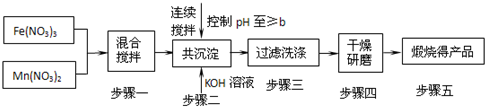
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
| 1000k |
| x |
| 2 |
| 2 |
| x |
| 2 |
| x |
查看答案和解析>>
科目: 来源: 题型:
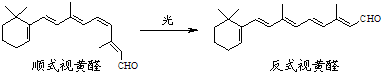
查看答案和解析>>
科目: 来源: 题型:
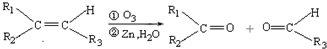 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)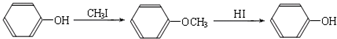

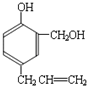



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com