
科目: 来源: 题型:
【题目】高氯酸铜易溶于水,在130'℃时会发生分解反应,是一种燃烧催化剂,以食盐等为原料制备高氯酸铜 [ Cu(ClO4)26 H2O) ]的一种工艺流程如下:
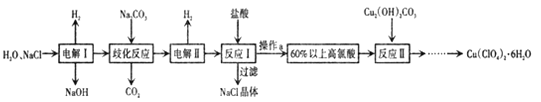
回答下列问题
(1)“电解I”的化学方程式为_________,所用交换膜是_(填“阳离子交换膜或“阴离子交换膜”) 。
(2)歧化反应是同一种物质中同种元素(自身氧化还原反应 ,已知上述工艺流程中“歧化反应”的产物之一为 NaClO3
①“歧化反应”的化学方程式为_。
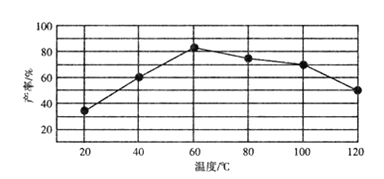
②“歧化反应”阶段不同温度对产率影响的结果如图所示。则该反应最适宜的温度是______。
(3)“电解II”的阳极产物为 ______(填离子符号).
(4) 该流程中可循环利用的物质是 _________(填化学式) 。
(5) 用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a千克。 最终制得的Cu( ClO4)2 6 H2O为b千克.则产率为_____(用含a、 b 的代数式表示) 。
(6) 某温度下 ,高氯酸铜可按A、B 两种方式同时分解.分解过程中铜的化合价不发生改变。A方式为Cu( ClO4)2![]() CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)光束通过Fe(OH)3胶体,可看到光亮的通路,这种现象叫__________________
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,求ACl2的摩尔质量________
(3)在标准状况下,测得4.2g气体A的体积是3360mL,则A可能是什么气体________
(4)在标准状况下15 g CO与CO2的混合气体,体积为11.2L。则:CO2和CO的体积之比是_____________
(5)在标准状况下,将224 L HCl气体溶于635 mL水(水的密度看作1g/mL)中,所得盐酸的密度为1.18 g·cm-3。所得盐酸物质的量浓度是___________
查看答案和解析>>
科目: 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式____________________。
(2)下列三种情况下,离子方程式与(1)相同的是_____(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
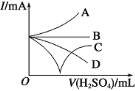
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度![]() 表示)可近似地用图中的_____曲线表示(填序号)。
表示)可近似地用图中的_____曲线表示(填序号)。
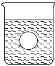
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将_____(选填“上浮”、“不动”、“下降”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H具有似龙延香、琥珀香气息,香气淡而持久,广泛用作香精的稀释剂和定香剂.合成它的一种路线如图:
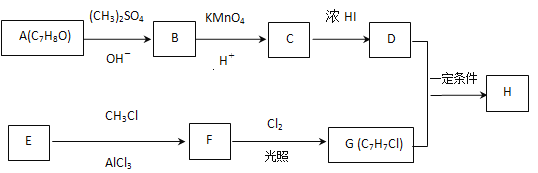
已知以信息:
①![]() ;
;
②核磁共振氢谱显示A的苯环上有四种化学环境不同的氢原子,且取代基的位置相邻;
③在D中滴加几滴FeCl3溶液,溶液呈紫色;
④芳香烃 F的相对分子质量介于90~100之间,0.1 mol F充分燃烧可生成7.2 g水;
⑤R1COOH+RCH2Cl![]() R1COOCH2R+HCl。
R1COOCH2R+HCl。
回答下列问题:
(1)A的化学名称是____,由C生成D的反应的化学方程式为______________。
(2)由F生成G的反应的化学方程式为____________,反应类型为____。
(3)H的结构简式为_________。
(4)苯环上有三个取代基且其中两个与A中所含的官能团相同,同时又能发生银镜反应的C的同分异构体有 (不考虑立体异构)_____种,其中核磁共振氢谱中有5组峰,且峰面积之比为1∶2∶2∶2∶1的同分异构体的结构简式是________(任写一种即可)。
(5)由苯酚和已有的信息经以下步骤可以合成化合物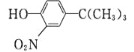
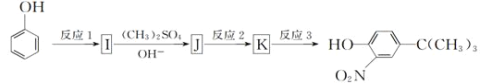
反应1所用的试剂为___,K的结构简式为____,反应3所用的试剂为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.![]()
B.![]()
C.![]()
D.![]()
(1)上述反应中,H2O2仅体现氧化性的反应是(填序号,下同)_________,H2O2仅体现还原性的反应是(填序号,下同)_________,H2O2既体现氧化性又体现还原性的反应是________。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是________
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:![]() 。已知该反应中H2O2只发生了如下过程:H2O2→O2。
。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①写出上述反应的离子方程式并配平_______________________________________
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为_______mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),发生以下反应:![]() ,试指出生成物A的化学式为________。
,试指出生成物A的化学式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:

已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目: 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____方法区分晶体、准晶体和非晶体。
(2)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 氢键 E 范德华力
(4)SF6被广泛用作高压电气设备绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系的键能。则S—F的键能为_______kJ·mol-1。

(5)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
①CuF比CuCl熔点高的原因是_____________;
② 已知NA为阿伏加德罗常数。CuF的晶胞结构如上“图b”。则CuF的晶胞参数a=__________nm (列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种清洁能源。工业上,常利用CO2和H2合成二甲醚。有关反应如下(z、y、z均大于0):
①2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH1=-xkJ·mol-1
CH3OCH3(g)+H2O(g) ΔH1=-xkJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-ykJ·mol-1
CO2(g)+H2(g) ΔH2=-ykJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3=-zkJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-zkJ·mol-1
(1)2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)ΔH=____kJ·mol-1。
CH3OCH3(g)+3H2O(g)ΔH=____kJ·mol-1。
(2)下列有关合成二甲醚的说法正确的是___(填字母)。
a.增大压强能提高反应速率和CO2的平衡转化率
b.体系中减小![]() ,平衡一定向正方向移动
,平衡一定向正方向移动
c.容器体积一定,混合气体密度不变时一定达到平衡状态
d.充入适量CO,可能提高CH3OCH3的产率
(3)在一定温度下,在恒容密闭容器中发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,升高温度,
CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,升高温度,![]() 将___(选填“增大”“减小”或“不变”)。
将___(选填“增大”“减小”或“不变”)。
(4)在恒容密闭容器中用CO2和H2合成二甲醚时CO2的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。
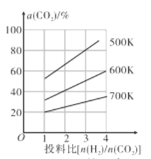
①500K时,将9molH2和3molCO2充入2L恒容密闭容器中,5min时反应达到平衡状态,则0~5min内的平均反应速率v(H2)=___molL-1min-l,该温度下,反应的平衡常数K=____(列出计算式即可,无需化简)。
②由图像可以得出的结论是___(答两条)。
(5)工业上也可用CO和H2合成二甲醚,而且二者还能作燃料电池的燃料。以CO、H2体积比为1∶2的混合气体与空气在KOH溶液中构成燃料电池(以石墨为电极),开始时,负极的电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E均可产生白色沉淀,其中A与B反应所产生沉淀不溶于酸,A与E反应所生成的白色沉淀可以溶于C或D;B与D、B与E产生沉淀;E与C、E与D反应均可产生二氧化碳气体;而C与D由于属于同一类物质,混合时无反应现象。
由此,可判定各试剂瓶中所盛试剂为(用化学式表示)
A________;B________;C________;D________;E________。
另外,请写出下面要求的离子方程式:
(1)A与E:
________________________________________________________。
(2)A与B:
_________________________________________________________。
(3)C与E:
__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】密闭容器中,反应aA(g)+bB(g)![]() cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
A. a+b<c+d
B. 平衡向正反应方向移动
C. D的体积分数减小
D. 达到新平衡时,A、B的浓度减小,C、D浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com