
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.金属镁与稀盐酸反应:Mg+2HCl === Mg2++2Cl-+H2↑
B.氯化钡溶液与硫酸反应:Ba2++![]() === BaSO4↓
=== BaSO4↓
C.碳酸钠溶液与盐酸反应:Na2CO3+2H+=== 2Na++CO2↑+H2O
D.盐酸与大理石反应:2H++![]() ===CO2↑+H2O
===CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为地壳中含量最多的金属元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
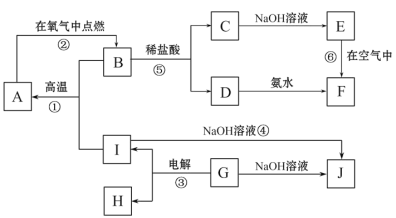
请填写下列空白:
(1)写出下列物质的化学式A_______________;G____________________;
(2)若C→D为化合反应,则此时的化学方程式_______________________________;
(3)写出E→F的化学方程式___________________________________________ ;
(4)写出反应④的离子方程式___________________________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体。(图中夹持及尾气处理装置均已略去)
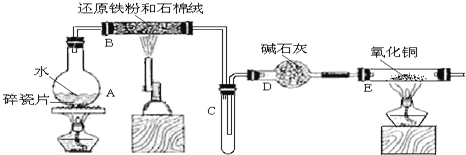
(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础。
(1)下列操作中,容量瓶所不具备的功能有________________ (填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液 C.测量容量瓶规格以下的任意体积的溶液 D.准确稀释某一浓度的溶液 E.量取一定体积的液体 F.用来加热溶解固体溶质
(2)如图是某些仪器的刻度部分示意图,图中各仪器虚线为所示读数。其中为量筒的是_______ (填编号),读数为_____mL。

(3)实验室用98%的浓硫酸配制(浓硫酸的密1.84g/mL)450mL 0.1 mol·L-1的硫酸。回答下列问题:
①配制中应选用的玻璃仪器除量筒、烧杯、玻璃棒、还有___________,应量取________mL 98%的浓硫酸。
②对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于0.1mol/L有_____(填序号)
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
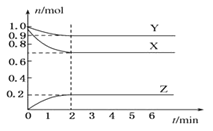
(1)该反应的化学方程式为___。
(2)反应开始至2min,气体Z的平均反应速率为___。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的___倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 ___(填”增大”“减小”或”相等”)。
③若此时将容器的体积缩小为原来的![]() 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为___反应(填“放热”或“吸热”)。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为___反应(填“放热”或“吸热”)。
(4)在一密闭容器中发生反应N2(g)+3H2(g) ![]() 2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
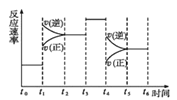
①处于平衡状态的时间段是___(填字母代号)。
A.t0t1 B.t1t2 C.t2t3 D.t3t4 E.t4t5 F.t5t6
②判断t1、t3、t4时刻分别改变的一个条件是:t1时刻___;t3时刻___;t4时刻___。 (填字母代号)
A. 增大压强 B.减小压强 C.升高温度 D. 降低温度 E.加催化剂 F.恒温恒容时充入氮气
③依据上述②中的结论,下列时间段中,氨的百分含量最高的是___(填字母代号)。
A.t0t1 B.t2t3 C.t3t4 D.t5t6。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,改变0.l mol/ L RCOOH溶液的pH, 溶液中 RCOOH、RCOO- 的微粒分布分数![]() 也随之改变,甲酸( HCOOH) 与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示.
也随之改变,甲酸( HCOOH) 与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示.
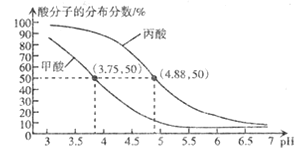
下列说法正确的是
A.丙酸的酸性比甲酸强
B.若0.1 mol/甲酸溶液的pH=2.33.则0.0lmol/L甲酸溶液的pH=3.33
C.将0.1mol/L的HCOOH溶液与0. 1 mol/L的HCOONa溶液等体积混合,所得溶液中:c( Na+ ) >c( H COO H ) >c( H COO- ) >c( OH-) >c ( H + )
D.CH3CH2COOHCH3CH2COO- +H+ lgK=-4 .88
查看答案和解析>>
科目: 来源: 题型:
【题目】2019 年 1月 3日,我国嫦娥四号探测器 ,首次实现了人类探测器在月球背面软着陆 ,五星红旗首次闪耀在月球背面,-170℃ 仍能保持本色.五星红旗基底采用探测器表面热控材料聚酰亚胺,某聚酰亚胺的结构简式如图。下列叙述正确的是
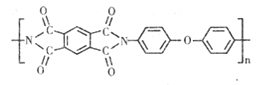
A.是天然有机高分子化合物
B.能耐高温,不能耐低温
C.该聚酰亚胺可发生取代反应和加成反应
D.该聚酰亚胺的一个链节中含有 13个双键
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,加入3mol A和1mol B,一定条件下发生反应3A(g)+B(g)![]() 2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持体积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是( )
2C(g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持体积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是( )
A. 6mol A+2mol B
B. 1.5mol A+0.5mol B+1mol C+0.5mol D
C. 3mol A+1mol B+2mol C+1mol D
D. 4mol C+1mol D
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料 、皮革 、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C ![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A.2L0.5mol/L Na2SO4 溶液中含有的氧原子数目为4NA
B.1 L0.1mo/L Na2S溶液中含有的阴离子数目小于0.1NA
C.生成 0.25mol还原产物时转移电子数为2NA
D.通常状况下11.2LCO2中含有的共价键数目为 2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com