
科目: 来源: 题型:
【题目】已知A是一种常见的一种金属,F是一种红褐色的沉淀。试根据图中转化关系,回答下列问题。

(1)写出A、B、D、E的化学式:A___、B___、D___、E___。
(2)检验D中阳离子的方法:___。
(3)保存C溶液时为什么加固体A___。
(4)写出下列转化的离子方程式
①C→E___。
②A→C___。
查看答案和解析>>
科目: 来源: 题型:
【题目】奥司他韦是一种高效、高选择性神经氨酸酶抑制剂,是目前治疗流感的最常用药物之一,是公认的抗禽流感、甲型H1N1等病毒最有效的药物之一。也是国家的战略储备药物。也有专家尝试使用奥司他韦作为抗新型冠状病毒(2019-nCoV)药物。以莽草酸作为起始原料是合成奥司他韦的主流路线。

Ⅰ.莽草酸是从中药八角茴香中提取的一种化合物,是合成奥司他韦的原料。下列有关莽草酸说法正确的是__
A 不能使酸性高锰酸钾溶液褪色
B 可以发生加成反应、消去反应、加聚反应、缩聚反应、取代反应
C 分子中所有原子共平面
D 只溶于苯等有机溶剂,不溶于水
Ⅱ.奥司他韦的合成路线如下:

已知:![]()
回答下列问题:
(1)化合物A的含氧官能团名称有:_______,反应③的反应类型:____。
(2)反应①的反应试剂和反应条件:____。
(3)请写出反应②的化学方程式:____。
(4)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有__种。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。C中有__个手性碳。
(6)结合以上合成路线设计由对甲基苯甲醛制备对醛基苯甲酸![]() 的合成路线____。
的合成路线____。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯酮(CH2=C=O)在一定条件下能跟含活泼氢原子的化合物发生加成反应,反应的通式可表示为CH2=C=O+HA=C=O+HA→![]() (极不稳定)→
(极不稳定)→![]() 试指出下列反应不合理的是( )
试指出下列反应不合理的是( )
A. CH2=C=O+HCl![]() CH3COCl
CH3COCl
B. CH2=C=O+H2O![]() CH3COOH
CH3COOH
C. CH2=C=O+CH3CH2OH![]() CH3COCH2CH2OH
CH3COCH2CH2OH
D. CH2=C=O+CH3COOH![]() ( CH3 C O)2O
( CH3 C O)2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关系正确的是( )
A. 沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B. 密度:CCl4>CHCl3>H2O>苯
C. 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D. 等质量的物质燃烧耗O2量:苯>乙烷>乙烯>甲烷
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. 氯乙烯、聚乙烯、苯乙烯都是不饱和烃
B. 化合物![]() 不是苯的同系物
不是苯的同系物
C. 甲苯与氢气完全加成后,再发生氯代反应,其一氯代物的同分异构体数目有4种
D. ![]() 分子中所有碳原子一定共平面
分子中所有碳原子一定共平面
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,微溶于浓KOH溶液;在酸性或中性溶液中不稳定,在0~5℃的强碱性溶液中较稳定。某实验小组欲制备高铁酸钾并测定其纯度。
Ⅰ.制备高铁酸钾(夹持装置略)
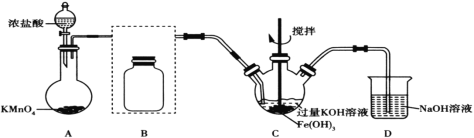
(1)装置A为氯气发生装置,其中盛放高锰酸钾的仪器名称为__。
(2)将除杂装置B补充完整并标明所用试剂__。
(3)装置C中Cl2与Fe(OH)3、KOH反应生成K2FeO4的化学方程式是____。
(4)实验时将装置C置于冰水浴中,其原因是____。
(5)实验后经结晶法得到的K2FeO4晶体仍含较多杂质,要得到更纯的晶体,还应采取的操作方法是____。
Ⅱ.测定产品纯度
(6)将wg K2FeO4粗产品溶于过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液VmL。已知该过程中涉及的离子反应主要有三个:
①Cr(OH)4+ FeO42-=Fe(OH)3↓+CrO42-+OH,
②_______,
③Cr2O72-+6Fe2++ 14H+=6Fe3+ +2Cr3+ +7H2O。
该粗产品中K2FeO4的质量分数为__(用含w、c、V的代数式表示)。若滴定管没有用标准液润洗,则测得的结果__(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)有①分液漏斗②量筒③容量瓶,使用前需检查是否漏液的是___(填序号)
(2)___molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等。
(3)标准状况下的四种气体:①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,密度最大的是___(填序号)
(4)10mL的CaCl2溶液里含2gCa2+,从中取出一半的溶液中Cl-的物质的量浓度是___。
(5)在Na2SO4和K2SO4的混合溶液中c(Na+)=0.2mol/L,c(SO42-)= amol/L,c(K+)=bmol/L时,a和b的关系是___。
(6)某物质A加热时按化学方程式2A=2B+C+3D分解,产物均为气体,测得由生成物组成的混合气体对H2的相对密度为20,则反应物A的摩尔质量为___。
(7)下列物质中:①铜 ②碳酸钙 ③氨气 ④氯气 ⑤空气 ⑥二氧化碳 ⑦氯化钠晶体 ⑧熔融硫酸钠。
属于电解质的是___, 非电解质的是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】兴趣小组探究实验室中制备Cl2的过程,为证明过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置,按要求回答问题:

(1)若用浓盐酸与足量的MnO2反应制Cl2。MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O。
①用双线桥表示该反应的电子转移___。
②___作氧化剂 ,___作还原产物。
(2)①装置B中盛放的试剂名称为___,作用是___。
②装置D和E中出现的不同现象说明的问题是___。
③写出装置G中发生反应的离子方程式:___。
查看答案和解析>>
科目: 来源: 题型:
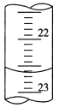
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是_____,该错误操作会导致测定结果___________
(2)判断滴定终点的现象是:________________________________________
(3)如图是某次滴定时的滴定管中的液面,其读数为_______ mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.胶体的本质特征是丁达尔效应
B.焰色反应是元素的性质,属于化学变化
C.密度为1.84g/ml、98%的硫酸,其物质的量浓度为1.84mol/L
D.NA个HCl分子的质量(以克为单位)与其相对分子质量在数值上相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com