氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
(1)直接热分解法制氢.某温度下,H
2O(g)?H
2(g)+
O
2(g).该反应的平衡常数表达式为K=
.
(2)热化学循环制氢.制备H
2的反应步骤如下:
①Br
2(g)+CaO(s)═CaBr
2(s)+
O
2(g)△H=-73kJ?mol
-1②3FeBr
2(s)+4H
2O(g)═Fe
3O
4(s)+6HBr(g)+H
2(g)△H=+384kJ?mol
-1③CaBr
2(s)+H
2O (g)═CaO(s)+2HBr(g)△H=+212kJ?mol
-1④Fe
3O
4(s)+8HBr(g)═Br
2(g)+3FeBr
2(s)+4H
2O(g)△H=-274kJ?mol
-1则 H
2O(g)?H
2(g)+
O
2(g)△H=
+249
+249
kJ?mol
-1.
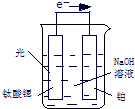
(3)光电化学分解制氢,其原理如图.钛酸锶光电极的电极反应为4OH
--4e
-═O
2+2H
2O,则铂电极的电极反应为
2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑)
2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑)
.
(4)水煤气法制氢.
CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H<0,在850℃时,K=1.
①若升高温度到950℃时,达到平衡时K
<
<
1(填“>”、“<”或“=”).
②850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H
2O、1.0mol CO
2 和x mol H
2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是
x<3
x<3
.
(5)甲烷制氢.将1.0mol CH
4和2.0mol H
2O (g)通入容积为100L的反应室,在一定条件下发生反应:CH
4(g)+H
2O(g)═CO(g)+3H
2(g).测得达到平衡所需的时间为5min,CH
4的平衡转化率为50%,则用H
2表示该反应的平均反应速率为
0.003 mol?L-1?min-1
0.003 mol?L-1?min-1
.
(6)LiBH
4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质.该反应的化学方程式为
2LiBH4═2LiH+2B+3H2↑
2LiBH4═2LiH+2B+3H2↑
.


 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.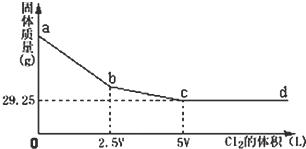 将Cl2通入NaBr和NaI的混合液中,待反应充分后将所得的溶液加热蒸干,并灼烧,最后将得到的固体冷却、称量.称量所得固体的质量与通入Cl2的体积关系如图所示.则原混合液中NaI的物质的量为( )
将Cl2通入NaBr和NaI的混合液中,待反应充分后将所得的溶液加热蒸干,并灼烧,最后将得到的固体冷却、称量.称量所得固体的质量与通入Cl2的体积关系如图所示.则原混合液中NaI的物质的量为( )