
科目: 来源: 题型:
【题目】喝茶,对很多人来说是人生的一大快乐,茶叶中含有少量的咖啡因。咖啡因具有扩张血管、刺激心脑等作用,在100 ℃时失去结晶水并开始升华,120 ℃时升华相当显著,178 ℃时升华很快。结构简式如下:
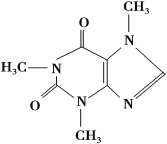
实验室可通过下列简单方法从茶叶中提取咖啡因:

(1)咖啡因的分子式为___________________________________________。
(2)步骤1浸泡茶叶所用的溶剂最好为________。
A.水 B.酒精 C.石油醚
(3)步骤1、步骤4所进行的操作或方法分别是________,________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列问题:
(1)相对分子质量为72且沸点最低的烷烃的结构简式为________。
(2)键线式![]() 表示的分子式为_________;1 mol该烃完全燃烧需消耗氧气的物质的量为_____mol。
表示的分子式为_________;1 mol该烃完全燃烧需消耗氧气的物质的量为_____mol。
(3)松油醇![]() 含有的官能团的名称为__________________.
含有的官能团的名称为__________________.
(4)分子式为C4H4且含两种官能团的链状有机物的结构简式为____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用右图所示装置进行NaHCO3的受热分解实验。请回答:

(1)加热一段时间后,烧杯中观察到的实验现象是______________,反应的离子方程式___________________。
(2)实验结束时的正确操作是__________(填序号),否则会引起_________________。
①先将导管从液体中移出,再熄灭酒精灯②先熄灭酒精灯,再将导管从液体中移出
(3)NaHCO3受热分解的化学方程式是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数, 下列说法正确的是( )
A.18g 水所含有的电子数目为NA
B.2g 氢气所含原子数为NA
C.过氧化钠与水反应生成标况下11.2L氧气电子转移的数目为NA
D.200 mL0.5mol/LNa2SO4溶液所含Na+数目0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2 是中学化学中的常见气体,也是大气污染物的主要组成成分。回答下列问题:
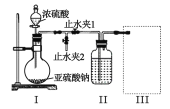
⑴甲组同学利用下列装置制备并收集干燥的 SO2:
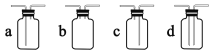
装置Ⅰ中盛装亚硫酸钠的仪器名称是_______,装置 II 的作用是对 SO2 气体进行干燥,该装置中所盛 试剂名称为_________,装置 III 为集气装置,应选取填入 III 中的集气装置为___________(选填字母代号)。
⑵乙组同学利用下列装置制备 SO2 并探究其性质:
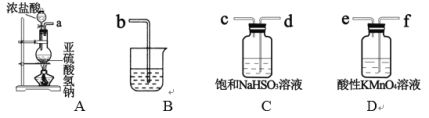
①该组同学的实验装置中,依次连接的合理顺序为a→_________。装置C中饱和NaHSO3溶液的作用是________。
②能证明SO2具有还原性的现象是___________,该反应的离子方程式为_________________。
③装置B的作用吸收SO2尾气,该装置中盛装的试剂是_______________。
⑶设计实验证明H2SO3为弱电解质:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】命名下列有机物或写出对应的结构简式。
(1)3-甲基-2-戊烯__________________________________________;
(2)丁酮_____________________________________________________;
(3)丙酸乙酯___________________________________________________;
(4)乙醚_____________________________;
(5)CH2=CH-COOH_________________________
(6)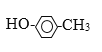 ________________________
________________________
(7)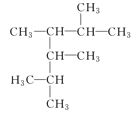 __________
__________
(8)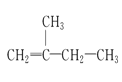 ______________________
______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各物质中,互为同位素的是 __________ ,互为同素异形体的是 ________ ,互为同系物的是______________ ,互为同分异构体的是_____________
①金刚石与石墨 ②12C与14C ③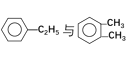 ④
④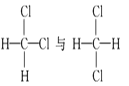 ⑤
⑤ ⑥
⑥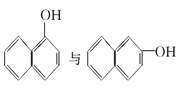 ⑦CH4与C(CH3)4
⑦CH4与C(CH3)4
查看答案和解析>>
科目: 来源: 题型:
【题目】砷在工业、农业、医学等领域用途非常广泛。回答下列问题:
⑴确定砷华(成分为 As2O3)是晶体还是非晶体,可通过______________加以确定。
⑵基态砷原子的价电子排布式为 ______________。
⑶ AsH3 空间构型为___________,NH3 沸点比 AsH3 高,其原因为__________________;药物胂凡纳明(![]() )分子中,共价键的类型有________ , 原子采用 sp2 杂化的有_____。
)分子中,共价键的类型有________ , 原子采用 sp2 杂化的有_____。
⑷砷酸(H3AsO4)的酸性比亚砷酸(H3AsO3)_______(填“强”或“弱”),其理由是 ______________。
⑸最近我国科学家研制的一种“稀磁材料”,其晶胞结构如下图所示。与 Zn 原子紧邻的 Zn 数目为_________个, 该晶体的密度为 _____________ g·cm-3(不必计算结果,写出表达式即可)。
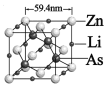
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都是22.4L
B. 同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C. 在标准状况下,体积为22.4L的物质都是1mol
D. 在非标准状况下,1mol任何气体的体积不可能是22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚主要用于替代汽车燃油、制氢及用于燃料电池原料。 回答下列问题
⑴二甲醚在加热条件下能发生分解:(CH3)2O(g)→CH4(g)+H2(g)+CO(g),在某温度压强下测定其动力学数据如下:
t/s | 0 | 200 | 400 | 600 | 800 |
c[(CH3)2O]/mol·L-1 | 0.01000 | 0.00916 | 0.00839 | 0.00768 | 0.00702 |
0~800s 的二甲醚平均反应速率为__________________ 。
⑵一种“直接二甲醚燃料电池”结构如下图所示,电解质为强酸溶液。电池工作时,能量转化方式为______,负极的电极反应式为 ____。
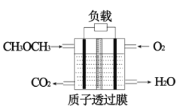
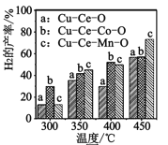
⑶二甲醚与水蒸气重整制 H2,相同投料比及流速时,单位时间内 H2 产率与催化剂及温度下关系如下图 所示,适宜的催化剂是______(选填 a、b、c)及适宜的温度是____ 。
⑷工业中用 CO 和 H2 为原料可制取二甲醚,在 250℃、5MPa 及催化剂作用下,在反应器中合成。
a:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) K1
b:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) K2
c:CO(g)+2H2(g) CH3OH(g)
已知:投料比 n(H2)/n(CO2)与原料气转化率的关系如下图 所示。
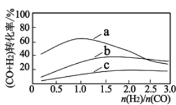
①最佳 n(H2)/n(CO)比为_________________ (填图中数字)。
②同一温度下,CO(g)+H2O(g) CO2(g)+H2(g)平衡常数为 K3,则 K3=__________用含 K1、K2 代数式表示)。
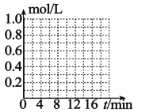
⑸已知反应 CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定条件下,向体积为 1L 的密闭容器中充入 1molCO2和 3molH2,测得 3min 时υ(H2)=0.5mol/L·min,10min 时达到平衡,平衡时,CO2 转化率为 75%,在下图中 画出 CO2 和 CH3OH(g)的浓度随时间变化曲线________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com