
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、 m、n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是
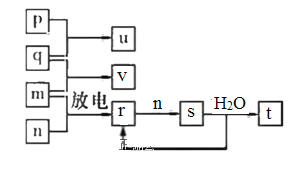
A.Y、W的最高价氧化物对应的水化物均为强酸
B.Z和Y的简单氢化物的稳定性和沸点高低均为:Z>Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.v的电子式可表示为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有HCl存在
B. 溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl2存在
D. 加入Na2CO3溶液,有气泡产生,说明有HClO分子存在
查看答案和解析>>
科目: 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列说法正确的是( )
表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温下![]() 的
的![]() 溶液中
溶液中![]() 与
与![]() 数目均为
数目均为![]()
B.![]() 葡萄糖和果糖的混合物中含羟基数目为
葡萄糖和果糖的混合物中含羟基数目为![]()
C.![]() 与足量
与足量![]() 反应,生成
反应,生成![]() 和
和![]() 的混合物,Na失去
的混合物,Na失去![]() 个电子
个电子
D.室温下,![]() 的
的![]() 溶液中,由水电离的
溶液中,由水电离的![]() 数目为
数目为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】将11.2g铁粉投入200mL的稀硫酸中,充分反应后,铁粉完全溶解。(假设反应后溶液体积不发生变化,写出计算过程)
⑴求标准状况下产生气体的体积。(已知:Fe+H2SO4=FeSO4+H2↑)_____________
⑵求反应后溶液中FeSO4的物质的量浓度。_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用![]() 溶液分别滴定浓度均为
溶液分别滴定浓度均为![]() 的
的![]() 、
、![]() 溶液,所得的沉淀溶解平衡图像如图所示(不考虑
溶液,所得的沉淀溶解平衡图像如图所示(不考虑![]() 的水解,
的水解,![]() ),下列说法正确的是( )
),下列说法正确的是( )
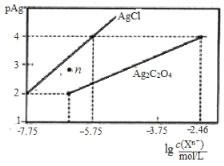
A.![]() 的数量级等于
的数量级等于![]()
B.n点表示![]() 的不饱和溶液
的不饱和溶液
C.向![]() 的混合液中滴入
的混合液中滴入![]() 溶液时,先生成
溶液时,先生成![]() 沉淀
沉淀
D.![]() 的平衡常数为
的平衡常数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
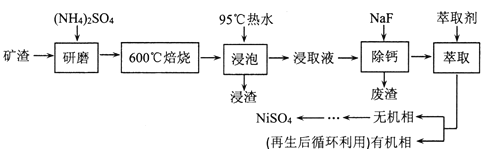
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。

(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。

①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述放热反应,X(g)+Y(g)![]() 2Z(g)+W(g);A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的( )
2Z(g)+W(g);A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的( )
![]()
A. 反应速率:v(B)>v(A) B. A容器中X的转化率为80%
C. 平衡时的压强:PB>2PA D. 平衡时Y体积分数:A>B
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组制备消毒液(主要成分是NaClO),设计了下列装置。
已知:Cl2和NaOH溶液能发生下列反应
在加热时:![]()
在低温时:![]()
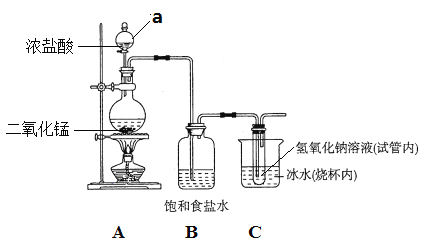
试回答下列问题:
⑴仪器a的名称是_____________。
⑵连接好装置,装药品之前,必须进行的一项操作是_________________。
⑶A装置内发生反应的化学方程式为_______________________________。
⑷B的作用是___________;冰水的作用是__________________________。
⑸该装置的不足之处有___________________________________________。
⑹一定温度下,向NaOH溶液中通入一定量的氯气,二者恰好完全反应。生成物中含有三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
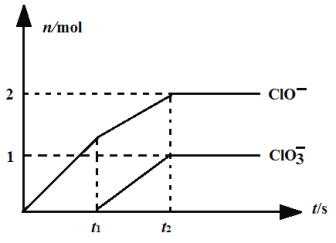
该过程中t2时刻参加反应的Cl2物质的量为_________mol;若另一过程产生的n(Cl-)为5.5mol,n(ClO3-)为1mol,则参加反应的NaOH物质的量为___________________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为 -5.5℃,易水解。已知:AgNO2 微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
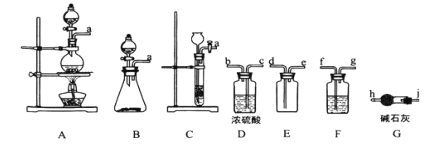
(1)制备 Cl2 的发生装置可以选用 _________ (填字母代号)装置,发生反应的离子方程式为________________________________________ 。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→_______→______→ _____→________→_______→______→______→______。(按气流方向,用小写字母表示,根据需要填,可以不填满,也可补充)。
(3)实验室可用下图示装置制备亚硝酰氯。其反应原理为:Cl2+2NO=2ClNO
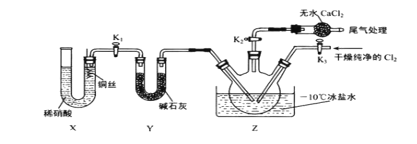
①实验室也可用 B 装置制备 NO , X 装置的优点为___________________ 。
②检验装置气密性并装入药品,打开 K2,然后再打开 K3,通入一段时间气体,其目的是 ___________________,然后进行其他操作,当 Z 中有一定量液体生成时,停止实验。
(4)已知:ClNO 与 H2O 反应生成 HNO2 和 HCl。
①设计实验证明 HNO2 是弱酸:_________________________________________。(仅提供的试剂:1 molL-1 盐酸、 1 molL-1HNO2 溶液、 NaNO2 溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO 样品的纯度。取 Z 中所得液体m g 溶于水,配制成 250 mL 溶液;取出 25.00 mL 样品溶于锥形瓶中,以 K2CrO4 溶液为指示剂,用 c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。滴定终点的现象是_____亚硝酰氯(ClNO)的质量分数为 _________。(已知: Ag2CrO4 为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com