
科目: 来源: 题型:
【题目】下列两种物质相互作用,反应条件或者反应物用量改变,不会引起产物种类改变的是( )
A.Na和O2B.NaOH和CO2C.Fe和Cl2D.HCl和Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A.将78Na2O2与过量H2O反应转移的电子数为NA
B.2molSO2与1molO2反应生成的SO3分子数为2NA
C.标准状况下,2.24L SO3中所含原子数为0.4NA
D.1molCl2参加反应转移电子数一定为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在硫酸铜溶液中加入过量KCN,发生反应:CuSO4+4KCN=K2[Cu(CN)4]+K2SO4。
回答下列问题:
(1)基态铜原子的电子排布式为_____________。
(2)N、O、S元素分别与H形成的二元共价化合物中,既含有极性共价键,又含有非极性共价键的化合物是_____________(填化学式,写出两种)。
(3)N2O5晶体由两种离子构成,已知其阴离子(NO3-)的立体构型为平面三角形,则其阳离子(NO2+)的立体构型为_____________,阳离子中氮的杂化方式为_____________。
(4)相同条件下,SO2、CO2在水中的溶解度较大的是_______________(填分子式),理由是_________________________________________________________________。
(5)N、O元素第一电离能的大小关系为__________(用元素符号表示),原因为____________。
(6)铜晶体为面心立方最密堆积,配位数为_____________,铜的原子半径为127.8 pm,NA表示阿伏加德罗常数的值,列出铜晶体的密度计算式:_____________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是![]()
A.“酸雨”、“臭氧层受损”、“光化学烟雾”都与氮氧化物有关
B.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径小于或等于2.5m的颗粒物,该值越高,代表空气污染程度越严重
C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理
D.为消除碘缺乏症,卫生部规定食盐中必须加含碘物质,食盐中所加含碘物质是KI
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示, 已知:ICl中氯为-1价,碘为+1价。下列有关说法正确的是
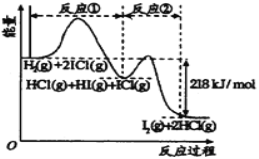
A.反应①为吸热反应
B.反应①和②均是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能有关
D.HI(g)+ICl(g) ![]() I2(g)+HCl(g) △H=-218 kJ/mol
I2(g)+HCl(g) △H=-218 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
下列说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO![]()
D.水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.50 g 34%H2O2溶液中含H-O键的数目为NA
B.180 g淀粉完全水解生成葡萄糖的分子数为NA
C.1 L 0.1 mol·L-1K2SiO3溶液中含SiO32-的数目为0.1NA
D.反应5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O,每生成1 mol ClO2转移电子的数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)反应③的ΔH_________0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时υ正_____υ逆(填“>”、“=”或“<”)。
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO(g)的浓度(mol·L-1)分别为0.2、0.1则:
①平衡时H2的转化率为________(保留一位有效数字)。
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比______________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)![]() CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl _______P2;A、B、C三点处对应平衡常数(KA、KB、KC)的由大到小的顺序为__________。(填“<”、“>”“=”)
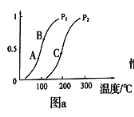
②100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则v(H2)=________________100℃时该反应的平衡常数K =_________。反应达到平衡的标志是:_____________。
A.容器内气体密度恒定
B.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C.容器的压强恒定
D.3v正(CH4)= v逆(H2)
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积 C.再充入CH4气体 D.使用合适的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com