
科目: 来源: 题型:
【题目】钛是一种银白色的过渡金属,有良好的抗腐蚀性,是强度重量比最高的金属。请回答下列问题:
⑴基态钛原子核外共有_____个填充了电子的原子轨道,其外围电子的轨道表达式为_____。
⑵金属钛有两种同素异形体。
①在较高温度时具有体心立方晶胞,其空间利用率为_______(用含π的式子表示)。
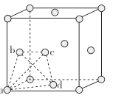
②在较低温度时,采用面心立方最密堆积,其晶胞中有若干个正四面体空隙(如下图中a、b、c、d四个钛原子形成一个正四面体,其内部为正四面体空隙),可以填充其他原子。若晶胞中所有的正四面体空隙中都填充1个氢原子,则形成的氢化钛的化学式为________。
⑶金属钛的熔点、硬度均比铝大,可能的原因是_______。
⑷TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是_______(填化学式)。
⑸有机合成中某种含钛催化剂的结构如图所示。
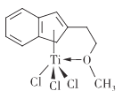
①组成该催化剂的元素中,电负性最大的是____(填元素名称)。
②该催化剂中碳原子的杂化方式为_____。
⑹配合物[TiCl(H2O)5]Cl2的配位数是__, 向含1 mol该配合物的水溶液中加入足量AgNO3溶液,可生成AgCl沉淀的物质的量为__。
⑺腈化钛(TiCN)可用于制备空气净化材料,已知氰气分子[(CN)2]中所有原子均满足最外层8电子稳定结构,则氰气分子中σ键和π键的个数比为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在做实验时引发了镁失火,他立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是
2MgO+C,下列关于该反应的判断正确的是
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于O原子得到的电子数目
查看答案和解析>>
科目: 来源: 题型:
【题目】在硫酸铝、硫酸钾和明矾的混合溶液中,硫酸根离子的浓度为0.4mol·L-1,当加入等体积0.4mol·L-1氢氧化钾溶液时,生成的沉淀恰好完全溶解。则反应后溶液中钾离子的浓度约为( )
A.0.225mol·L-1B.0.25mol·L-1C.0.45mol·L-1D.0.9mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
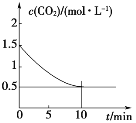
该条件下反应的平衡常数为_____;若铁粉足量,CO2的起始浓度为2.0mol·L-1,则平衡时CO的浓度为____mol·L-1。
②下列措施中能使平衡时![]() 增大的是___(填字母)。
增大的是___(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目: 来源: 题型:
【题目】将相同质量的镁条分别在①氧气、②空气、③氮气、④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序( )
A.③<②<①=④B.④=①=②=③
C.③<②<①<④D.③<①<②<④
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤烟气中含有一定量的二氧化硫,会造成大气污染。一定条件下,通过下列反应可以实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) H, 请回答:
2CO2(g)+S(l) H, 请回答:
⑴已知CO(g)+![]() O2(g)=CO2(g) △H1=-a kJ·mol-1
O2(g)=CO2(g) △H1=-a kJ·mol-1
S(s)+O2(g)=SO2(g) H2=-b kJ·mol-1
S(l)=S(s) H3=-c kJ·mol-1
则△H=_______kJ·mol-1。
⑵一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,在不同条件下进行反应:2CO(g)+SO2(g)![]() 2CO2(g)+S(l),反应体系总压强随时间的变化如图所示:
2CO2(g)+S(l),反应体系总压强随时间的变化如图所示:
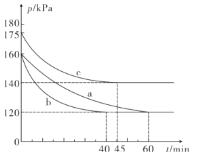
①图中三组实验从反应开始至达到平衡时的反应速率v(CO)由大到小的次序为___( 填实验序号); 与a组相比,c组改变的实验条件可能是___。
②若b组反应进行到40min时达到平衡状态,此时测得容器中气体的密度比反应前减少了12.8 g·L-1,则CO的物质的量浓度c(CO)=___,反应在此条件下的化学平衡常数K=___
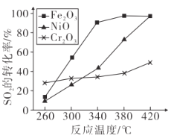
⑶其他条件相同、催化剂不同时,SO,的转化率随反应温度的变化如下图,260°C时,______(填Fe2O3、NiO或Cr2O3)作催化剂反应速率最快;Fe2O3和NiO作催化剂均使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是_______。
⑷SO2—O2质子交换膜燃料电池实现了制硫酸、发电、环保三项目标,此电池的负极反应式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
则2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=____。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若反应开始到10s时间段内,v(H2)=____。
②若TK时,化学平衡常数K=15,则10s时v(正)___v(逆)(填“>”“<”或“=”),此时CO2的转化率为____。
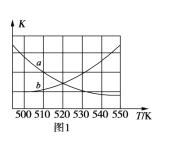
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和ymolH2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为___(填“a”或“b”)。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为___(填“a”或“b”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,我国北京等地出现严重雾霾天气,据研究,雾霾的形成与汽车排放的 CO、 NO2 等有毒气体有关,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气 体,反 应方程式为4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)ΔH=-1200kJ/mol。对于该反应, 温度不同(T2 > T1 )其他条件相同时,下列图像正确的是
4CO2(g)+N2(g)ΔH=-1200kJ/mol。对于该反应, 温度不同(T2 > T1 )其他条件相同时,下列图像正确的是
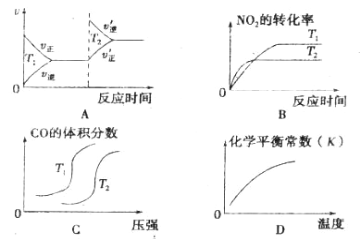
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25° C时,二元酸H2X的电离平衡常数K1=5.0×10-2,K2=5.4×10-5。此温度下用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KY和K2X溶液,所得的沉淀(AgY和Ag2X)溶解平衡图像如图所示。下列叙述正确的是
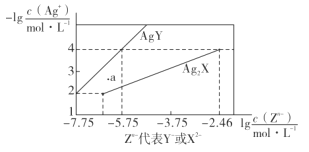
A.25°C时,KHX的溶液pH>7
B.反应Ag2X+2Y- 2AgY+ X2-的平衡常数为103.29
C.a点既可以表示AgY的不饱和溶液也可以表示Ag2X的过饱和溶液
D.向c(Y-)=c(X2-)=0.01 mol·L-1的混合液中滴入AgNO3溶液时,先生成AgY沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是工业上制取纯硅的一种方法。

请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有____(填反应代号);
(2)写出反应③的化学方程式____;
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____;
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是___(填化学式);分别通入W溶液中能得到白色沉淀的气体是___(填化学式);
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com