
科目: 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
B. 标准状况下,18 g H2O所占的体积约是22.4 L
C. 32 g O2在标准状况下所占的体积约为22.4 L
D. 2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】焰色实验过程中,铂丝的清洗和灼烧与钾焰色实验的观察两项操作如图所示,下列叙述中不正确的是( )

A.每次实验中都要先将铂丝灼烧到火焰颜色,再蘸取被检验物质
B.钾的焰色实验要透过蓝色钴玻璃观察
C.焰色实验是某种金属元素灼烧时所具有的特殊颜色,是化学变化
D.没有铂丝可用无锈铁丝代替进行实验
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室采用下列方法制取NH3:
①固体Ca(OH)2与NH4Cl共热。
②NH4HCO3固体中加NaOH固体(过量),常温下即能产生NH3;装置如图。
![]()
③NaOH固体中加入浓氨水。
④NH4Cl浓溶液中加生石灰。
请回答下列问题:
(1)写出②方法制取氨气的化学方程式___________________________。
(2)说明③方法制取氨气的原理:_____________,为什么此法不加热? __________。
(3)请从下面的仪器中选择④方法制取氨气的发生装置________(写字母,要求使用仪器最少、合理)。

写出用NH4Cl浓溶液与生石灰反应制取氨气的理由:__________。
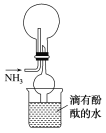
(4)某同学设计了如图装置收集氨气,下列说法不正确的是________(填字母)。
A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)汽车尾气中的 NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10 mol CO和8 mol NO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图。
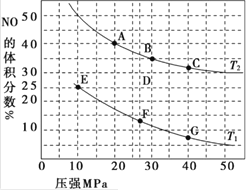
①已知该反应在较低温度下能自发进行,则反应 2NO(g)+2CO(g)![]() N2(g)+2CO2 (g),ΔH______0(填“>” “=”或“<”)。
N2(g)+2CO2 (g),ΔH______0(填“>” “=”或“<”)。
②该反应达到平衡后,为同时提高反应速率和CO的转化率,可采取的措施有______ (填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加 NO 的浓度 d.升高温度
(2)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3 和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。
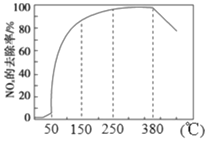
解释在50 ℃~150 ℃范围内随温度升高,NOx 的去除率迅速上升的原因是_______
(3)NH3催化还原氮氧化物技术是目前应用最广泛的烟气脱氮技术:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) ΔH<0。密闭容器中,在相同时间内,在催化剂 A作用下脱氮率随温度变化如图所示。
5N2(g)+6H2O(g) ΔH<0。密闭容器中,在相同时间内,在催化剂 A作用下脱氮率随温度变化如图所示。
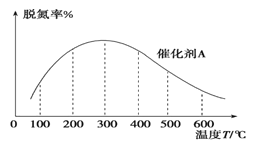
现改用催化能力稍弱的催化剂B进行实验,请在上图中画出在催化剂 B作用下的脱氮率随温度变化的曲线_________(不考虑温度对催化剂活性的影响)。
(4)某研究小组利用反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △ H= -34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得 NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △ H= -34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得 NO的转化率随温度的变化如图所示:
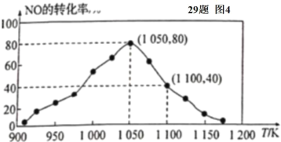
①由图可知,在 1050 K 前,反应中 NO的转化率随温度升髙而增大,其原因为____________; 在 1100 K 时,N2的体积分数为____________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 Kp )。在 1050 K、1.1×106 Pa 时,该反应的化学平衡常数 Kp=____________(已知:气体分压(P分) =气体总压(Pa)×体积分数)
查看答案和解析>>
科目: 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) AH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
CH3OH(g) AH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
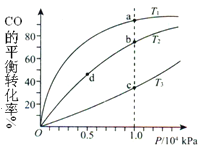
A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在一定体积的密闭容器中,下列叙述不能作为可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡状态标志的是 ( )
2C(g)达到平衡状态标志的是 ( )
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧B. ④⑦C. ①③D. ⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。
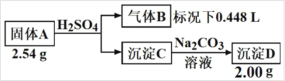
气体B为黄绿色气体单质, 沉淀C和D焰色反应为均为砖红色。
(1)组成A的三种元素是______,A的化学式是______
(2)固体A与足量稀硫酸反应的化学方程式是______。
(3)请从化学反应原理的角度解释(结合化学方程式)为什么沉淀C能转化成 D______。
Ⅱ.常用的补铁剂有硫酸亚铁等,而乳酸亚铁被人体吸收的效果比无机铁好,它溶于水形成淡绿色的透明溶液,几乎不溶于乙醇。它的制备方法有两种:一是在FeCO3中加入乳酸;二是利用废铁屑制取纯净的三水合乳酸亚铁晶体,其实验流程如下图所示:
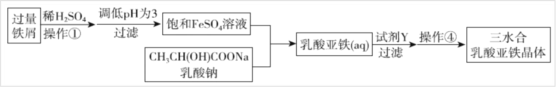
(1)写出制备方法一的离子反应方程式_______;
(2)操作①中不需要用到的仪器为________;
A.玻璃棒 B.坩埚 C.坩埚钳 D.蒸发皿
(3)加入过量的试剂Y为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L恒容密闭容器中充入![]() 、
、![]() ,在一定条件下发生如下反应:
,在一定条件下发生如下反应:![]()
![]() ;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )

A.工业上,利用上述反应合成甲醇,温度越高越好
B.图象中X代表温度,![]()
C.图象中P点代表的平衡常数K为![]()
D.温度和容积不变,再充入![]() 、1 mol CO,达到平衡时CO的转化率减小
、1 mol CO,达到平衡时CO的转化率减小
查看答案和解析>>
科目: 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
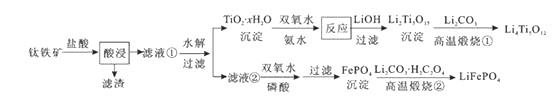
下列说法不正确的是( )
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O↑+3CO2↑
2LiFePO4+H2O↑+3CO2↑
D.TiO2 · xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/ ℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
可知,40 oC前,未达到平衡状态,随着温度升高,转化率变大;40 oC后,H2O2分解加剧,转化率降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com