
科目: 来源: 题型:
【题目】按要求填空。
(1)过氧化钠与CO2反应的化学方程式:__;
(2)铁与水蒸气反应的化学方程式:__。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,配制完毕后要加入少量铁屑,其目的是___,向FeSO4溶液中滴加NaOH溶液,并放置一段时间,此过程中观察到的现象__。
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项中所示的物质间转化均能实现的是( )
A.Al(s)![]() Al(OH)3(s)
Al(OH)3(s)![]() Al2O3(s)
Al2O3(s)
B.FeS2(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
C.Cl2(g)![]() NaClO(aq)
NaClO(aq)![]() HClO(aq)
HClO(aq)
D.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是( )
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,
通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如下图所示。
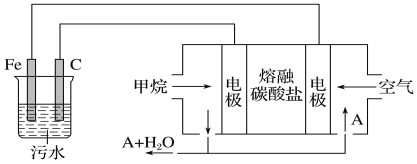
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e-=O2↑+4H+,则另一个电极反应式为_____________________________。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为_____________________________。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①正极的电极反应式为______________________________________;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是___________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出).

(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),某温度下,将1mol CO2和3mol H2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0. 90 | 0. 85 | 0. 83 | 0. 81 | 0. 80 | 0. 80 |
①用H2表示前2h平均反应速率v(H2)=___.
②该温度下CO2的平衡转化率为___.
(2)在300℃、8MPa下,将二氧化碳和氢气按物质的量之比为1:3通入一恒压密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp=______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H=-92. 4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H=-92. 4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。

①在10~20 min内,NH3浓度变化的原因可能是_______。
A. 加入催化剂 B. 缩小容器体积 C. 降低温度 D. 增加NH3的物质的量
② 20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是____________,35min达到第二次平衡,则平衡的平衡常数K1______K2(填“>”“<”或“ = ”)
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为______________________________________________。
②部分化学键键能数据如下:
化学键 | O=O | C=O | C≡O |
E/(kJ·mol) | 494 | 799 | 1076 |
△H2=__________kJ·mol-1
(2)1573K时,N2+O2![]() 2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
(3)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1. 68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是________________,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要_____________。
(4)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)→NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)→NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A. 反应速率与NO浓度有关 B. 反应速率与NO2浓度有关
C. 反应的中间产物只有NO3 D. 第二步反应活化能较高
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。已知储氢装置的电流效率![]() ×100%,下列说法不正确的是
×100%,下列说法不正确的是
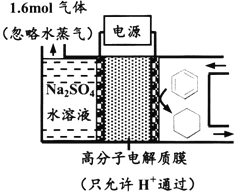
A. 采用多孔电极增大了接触面积,可降低电池能量损失
B. 过程中通过C-H键的断裂实现氢的储存
C. 生成目标产物的电极反应式为C6H6+6e-+6H+===C6H12
D. 若![]() =75%,则参加反应的苯为0.8mol
=75%,则参加反应的苯为0.8mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用石墨电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=4NH4++AlO2-+2H2O
C.乙醛与新制Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
D.向Ba(OH)2溶液中加入过量NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
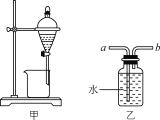
A.用装置甲分液时,两层液体应依次从下口放出
B.用装置乙除去NO中混有的少量NO2时,应将混合气体从a管通入
C.中和滴定时,锥形瓶应先用待测液润洗2~3次
D.配制溶液时加水超过容量瓶的刻度线,应立即用胶头滴管吸出
查看答案和解析>>
科目: 来源: 题型:
【题目】高能锂离子电池总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法正确的是
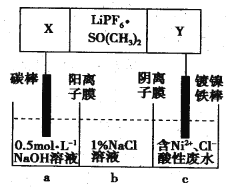
A. LiPF6·SO(CH3)2可用Li2SO4水溶液代替
B. 当转移1mol e-时,b室离子数增加NA个
C. 该电池充电时阳极反应式为Fe+Li2S-2e-=FeS+2Li+
D. 若去除图阴离子膜,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com