
科目: 来源: 题型:
【题目】将钠、镁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积比是( )
A.1∶2∶3B.6∶3∶2C.3∶1∶1D.1∶1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外活动小组利用废铁屑(含少量硫等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O],并设计了如图所示的装置(夹持仪器略去)。
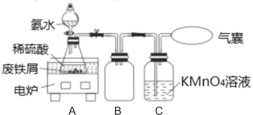
称取一定量的表面除去油污的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60℃热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)相比通常铁与稀硫酸生成氢气的条件,在实验中选择50~60℃热水浴的原因是___;锥形瓶中溶液冷却至室温后再加入氨水的原因__。
(2)C瓶中KMnO4溶液的作用是__。
(3)若要确保获得浅绿色悬浊液,下列符合实验要求的是__(填字母)。
a.保持铁屑过量
b.控制溶液呈强碱性
c.将稀硫酸改为浓硫酸
(4)莫尔盐是一种重要化学药品,较绿矾稳定,不易被空气氧化,是化学分析中常用的基准物之一。其组成可用(NH4)2SO4FeSO46H2O或(NH4)2Fe(SO4)26H2O表示。一定条件下,(NH4)2Fe(SO4)2发生分解:4(NH4)2Fe(SO4)2=2Fe2O3+5SO2↑+3SO3↑+N2↑+6NH3↑+7H2O下列叙述正确的是__。
a反应生成amolN2时,转移电子的物质的量为6amol
b该反应的还原产物是硫的两种氧化物
c有amol电子转移时,生成SO2的物质的量为0.1amol
d将气体产物用足量BaCl2溶液吸收,只得到一种沉淀物
(5)实验探究:影响溶液中Fe2+稳定性的因素。
配制0.8mol/L的FeSO4溶液(pH=4.5)和0.8mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2ml上述溶液于两支试管中,刚开始两种溶液都呈浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,过了一会儿观察可见(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其它条件相同时,在一定pH范围内,溶液pH越小Fe2+稳定性越好。
假设3:___。
(6)称取ag所制得的硫酸亚铁铵晶体,用加热煮沸的蒸馏水溶解,配成250mL溶液,取出25mL放入锥形瓶中,用cmol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___(用含c、V、a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现用氯水来制取含有次氯酸的溶液,既要提高溶液中HClO物质的量浓度,又要降低溶液中HCl浓度,下列措施可以采用的是( )
A. 加热挥发HCl B. 加CaSO3
C. 加NaOH中和HCl D. 加CaCO3中和HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取Cl2的反应:
4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O。下列说法不正确的是( )
MnCl2+Cl2↑+2H2O。下列说法不正确的是( )
A.氧化剂是MnO2,还原剂是HCl
B.每生成1 mol Cl2,转移电子的物质的量是2 mol
C.每消耗1 mol MnO2,表现还原作用的HCl为4 mol
D.Cl2是氧化产物
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
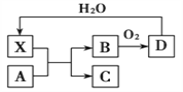
A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
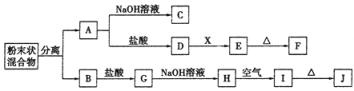
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在化学科学研究中,物质发生化学反应的反应热可通过实验测定,也可通过化学计算的方式间接地获得。
(1)实验方法测反应反应热
①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要___________、___________。
为了减少实验误差:实验过程中将NaOH溶液________(选填“一次”或“分多次”)倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的________,记为终止温度。
②实验测定在一定温度下,0.2 molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33 kJ的热量。该反应的热化学方程式_________________________________。
(2)通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H=________kJ·mol-1
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8 kJ·mol-1。
已知:2H2(g)+ O2(g) = 2H2O (l) △H=-571.6 kJ·mol-1
H2(g)+![]() O2(g) = H2O(g) △H=-241.8 kJ·mol-1
O2(g) = H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为__________kJ·mol-1;
CH3OH(g)+O2(g) = CO(g)+2H2O(g) △H=_______kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
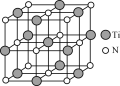
【题目】I 金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1) Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
① Ti2+基态电子排布式可表示为_______。
② 与BH4-互为等电子体的阳离子的化学式为_______。
(2) 二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如下图所示。
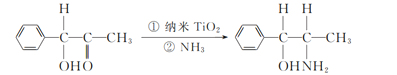
甲 乙
化合物乙的分子中采取sp3杂化方式的原子个数为_______。
(3) 水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1 mol [Ti(OH)2(H2O)4]2+中σ键的数目为_____。
(4) 氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
II Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)Cu基态核外电子排布式为_____。
(2)SO42-的空间构型为_____(用文字描述);Cu2+与OH反应能生成[Cu(OH)4]2,[Cu(OH)4]2中的配位原子为_____(填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为_____;推测抗坏血酸在水中的溶解性:_____(填“难溶于水”或“易溶于水”)。

图1 图2
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。
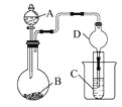
(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目: 来源: 题型:
【题目】大气污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。
(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。
①使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式:_____________________。
②醛类、O3、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟雾称为光化学烟雾。某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图1所示。请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议:________________________________。
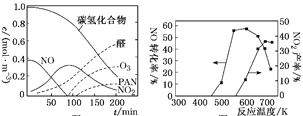
图1 图2
(2)利用NH3催化还原氮氧化物(SCR技术)是目前应用广泛的烟气脱硝技术。SCR技术的主要反应之一为4NO(g)+4NH3(g)+O2(g) ![]() 4N2(g)+6H2O(g)ΔH=-1627.2 kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700 ℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是__________________________。(用化学方程式表达)
4N2(g)+6H2O(g)ΔH=-1627.2 kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700 ℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是__________________________。(用化学方程式表达)
(3)目前,科学家还在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。

图3 图4
①写出该脱硝原理总反应的化学方程式_____。(已知NO与C2H4体积比为3:1)
②为达到最佳脱硝效果,应选择的条件是_________________________________。
(4)NO(g)与CO(g)催化转化成N2(g)和CO2(g)的反应达到平衡后,20min时,若改变反应条件,导致N2浓度发生如下图5所示的变化,则改变的条件可能是________(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2的量 D.缩小容器体积


图5 图6
(5)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g) +NO(g),正反应速率随时间变化如图6所示。由图可得出的正确结论是___(填字母)
SO3(g) +NO(g),正反应速率随时间变化如图6所示。由图可得出的正确结论是___(填字母)
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com