
科目: 来源: 题型:
【题目】新型微生物电池可利用生活垃圾发电,其工作原理如图所示,下列有关说法中错误的是( )
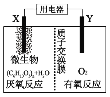
A.X电极的反应式为:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+
B.每消耗1molO2时会有4mol质子通过质子交换膜
C.工作时外电路电流由负极流向正极
D.微生物所起作用与催化剂相当
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验装置、操作中不能实现相应实验目的的是 ( )
A | B | C | D | |
装 置 |
|
|
|
|
目的 | 证明AlCl3是共价化合物 | 证明在NaOH的乙醇溶液中加热溴乙烷时有乙烯生成 | 证明氯气氧化性强于I2 | 比较Ksp(AgCl)、Ksp(AgBr)的相对大小 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】某饱和链烃的含氧衍生物X具有如下性质:X+H2O![]() Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
A.10种B.8种C.7种D.6种
查看答案和解析>>
科目: 来源: 题型:
【题目】橡胶行业是国民经济的重要基础产业之一,在现代生产、军事工业、医疗行业中有广泛应用。如图是生产合成橡胶G和医用高分子材料C的路线图,已知B的分子式为C6H10O3。请回答下列问题:

(1)X中的含氧官能团名称是___,X的核磁共振氢谱有___组峰。
(2)A→B的反应类型是___。
(3)C的结构简式是___。
(4)X发生银镜反应的化学方程式为___。
(5)写出E→F的化学反应方程式___。
(6)A有多种同分异构体,其中属于酯类且含有碳碳双键的共有___种(不含立体异构)。
(7)已知:①![]() ②
②![]() +SOCl2→
+SOCl2→![]() +SO2+HCl。请将下列以
+SO2+HCl。请将下列以 为原料制备
为原料制备 的合成路线流程图补充完整___(无机试剂任用)。
的合成路线流程图补充完整___(无机试剂任用)。

![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】随着5G时代的到来,半导体材料将迎来快速发展,三氯化氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室利用PCl3、SO2、Cl2在60~65°C时反应制备POCl3和SOCl3的实验装置如图所示(气体的制备装置未画出)。
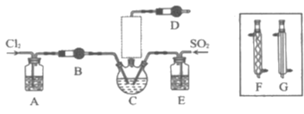
资料卡片:
物质 | 熔点/°C | 沸点/°C | 其他 |
PCl3 | -93.6 | 76.1 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 遇水剧烈水解,能溶于PCl3 |
SOCl3 | -105 | 78.8 | 遇水剧烈水解,受热易分解 |
(1)该反应的化学方程式为___。
(2)A、B装置中的试剂分别是___、___。
(3)装置E的作用是___。
(4)反应装置的虚线框中未画出的仪器最好选用___(填“F”或“G”),理由是___。
(5)反应结束后,提纯POCl3的操作是___(填操作名称)。
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取4.000g样品在水解瓶中摇动至完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.4000molL-1的AgNO3溶液25.00mL,再加少许硝基苯,用力振荡。加入NH4Fe(SO4)2作指示剂,用0.l000molL-1KSCN标准溶液滴定过量的AgNO3至终点,消耗KSCN标准溶液22.00mL。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,Ag3PO4可溶于硝酸,POCl3的相对分子质量为153.5]
①加入少量的硝基苯的目的是___。
②POCl3的质量分数为___。(保留一位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
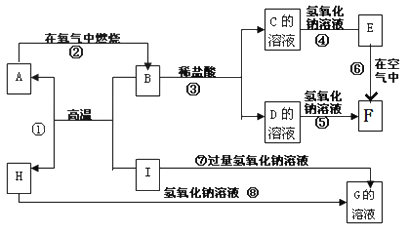
请填写下列空白:
(1)B的俗称_______,反应①的用途_____(填一项)。
(2)反应①的化学方程式为________。反应③的离子方程式为_________。反应⑧的化学方程式为______。
(3)反应⑥的化学方程式及变化过程中的现象是__________。
(4)向G溶液中加入AlCl3溶液的离子方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】《自然》杂志于2018年3月15日发布,中国留学生曹原用石墨烯实现了常温超导。这一发现将在很多领域发生颠覆性的革命。镓(Ga)、硒(Se)的单质及某些化合物如砷化镓等都是常用的半导体材料,超导和半导体材料都广泛应用于航空航天测控、光纤通讯等领域。请回答下列与碳、砷、镓、硒有关的问题。
(1)基态硒原子的核外价层电子排布式为___,与硒同周期的p区元素中第一电离能大于硒的元素有___种,SeO3的空间构型是___。
(2)化合物[EMIM][AlCl4]具有很高的应用价值,EMIM+结构如图所示。
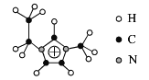
①EMIM+离子中各元素电负性由大到小的顺序是___。
②EMIM+离子中碳原子的杂化轨道类型为___。
③大π键可用符号π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示___。
表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示___。
(3)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯如图所示,转化后1号C原子与相邻C原子间键能变小,原因是___。

(4)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示,Ga和As的原子半径分别为apm和bpm,GaAs晶胞中原子的体积占晶胞体积的百分率为A,则阿伏加德罗常数的值为NA=___。(用字母表示)

查看答案和解析>>
科目: 来源: 题型:
【题目】取50 mL某浓度的稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液体积的关系如图所示。求原硫酸的物质的量浓度______。

查看答案和解析>>
科目: 来源: 题型:
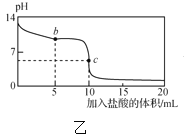
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示[其中a点的坐标为(9.5,0.5)]。下列溶液中的关系中正确的是( )
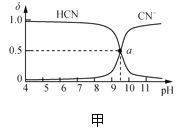
A.常温下,HCN的电离平衡常数:Ka(HCN)=10-4.5
B.图甲中pH=7的溶液:c(Cl-)=c(HCN)
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将1.00mol·L-1盐酸滴入20.00mL1.00mol·L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示。

下列有关说法中不正确的是( )
A. a点溶液中离子浓度大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. b点溶液中离子浓度大小关系:c(NH4+)=c(Cl-)>c(H+)=c(OH-)
C. c点溶液中离子浓度大小关系:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
D. d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com