
科目: 来源: 题型:
【题目】(1)在现用周期表中氧族元素包括 ______________________(填元素名称)五种元素,其中Se的基态原子的电子排布式为______________________,元素X与Se同周期,X元素原子核外未成对电子数最多,X为______________________(填元素符号)。
(2)与氧同周期的相邻元素中,第一电离能有大到小的顺序______________________。
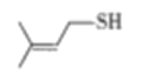
(3)臭鼬排放的臭气主要成分为3—MBT(3—甲基—2—丁烯硫醇,结构如图)。1mol3—MBT中含有σ键数目为____________(NA为阿佛加德罗常数的值)。沸点:3—MBT____________(CH3)2C==CHCH2OH(填“>”“<”或“=”),主要原因是________________________。
(4)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法正确的是__________(填序号)。
A.中心原子的价层电子对数不相等
B.都是极性分子
C.中心原子的核对电子数目不相等
D.都含有极性键
②SO3分子的空间构型为__________,与其互为等电子体的阴离子为__________(举一例)。
(5)单质Po是有__________键形成的晶体;若已知Po的摩尔质量为Mg·mol-1,原子半径为rpm,阿伏加德罗常数的值为NA,则钋晶体的密度的表达式为____________________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】把 NaOH、MgCl2、AlCl3 三种固体组成的混合物溶于足量水后,产生 1.16g 白色沉淀, 再向所得浊液中逐渐加入 2.00mol/LHCl 溶液,加入HCl 溶液的体积与生成沉淀的关系如图所示。
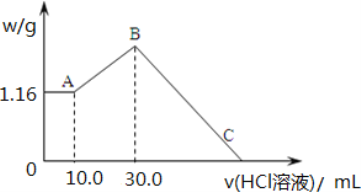
(1)A 点沉淀物的化学式为_____。B 点纵坐标为___________________。
(2)A 点至B 点改为通入二氧化碳气体,至少须标准状况下二氧化碳_____mL。此时发生反应的离子方程式为_____。
(3)B 点含溶质的物质的量是_____mol。C 点(此时沉淀恰好完全溶解)HCl 溶液的体积为_____mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】橙花醇具有玫瑰及苹果香气,可作为香料。其结构简式如图所示,下列关于橙花醇的叙述,错误的是
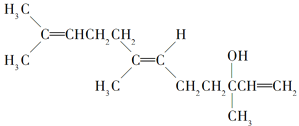
A.既能发生取代反应,也能发生加成反应
B.在浓硫酸催化下加热脱水,可以生成不止一种四烯烃
C.1 mol橙花醇在氧气中充分燃烧,需消耗470.4 L氧气(标准状况)
D.1 mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240 g Br2
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可用甲烷和氧气按9:1的体积比混合,在200℃和10MPa的条件下,通过铜制管道反应制得甲醇:2CH4+O2=2CH3COH。
(1)已知一定条件下,CH4和CH3COH燃烧的热化学方程式分别为:
CH4(g)+SO2(g)=CO2(g)+2H2(g) △H=-802kJ/lmol
CH3OH(g)+l.5O2(g)=CO2(g)+2H2O(g) △H=-677kJ/mol
则2CH4(g)+O2(g)=2CH3OH(g) △H=__________
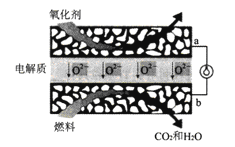
(2)甲烷固体氧化物燃料电池属于第三代燃料电池,是一种在中高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置。其工作原理如下图所示。a是电池的____极(填“正”或“负”) ,b极的电极反应式为__________。
(3)工业上合成甲醇的另一种方法为:
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90kJ/mol
CH3OH(g) △H=-90kJ/mol
T℃时,将2mol CO 和4molH2充入1L 的密闭容器中,测得H2的物质的量随时间变化如下图实线所示。
① 能用于判断反应已达化学平衡状态的是____________。
A.气体的总压强不再改变
B. H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗1mol CO,同时生成1mol CH3OH
② 请计算出T℃ 时反应的平衡常数K=_________________。
③ 仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是:________;曲线Ⅱ对应的实验条件改变是_________0。

④ a、b、c三点逆反应速率由大到小排列的顺序是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断正确的是
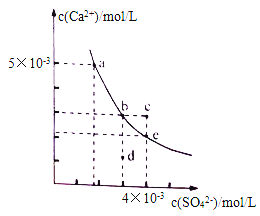
A. 曲线上任意一点的Ksp都相同
B. 在CaSO4饱和溶液中加入Na2SO4固体,可使溶液由b点变化到c点
C. 蒸发水后,可使溶液由d点变化到b点
D. 常温下,CaSO4的Ksp的数量级为10-5
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数为NA,则下列说法正确的是
A.工业合成氨每断裂NA个N≡N键,同时断裂3NA个N-H键,则反应达到平衡
B.常温常压下,16g甲烷所含有的原子数目为NA
C.标准状况下,2.24L戊烷充分燃烧后生成的CO2的体积为11.2 L
D.常温下,CH4发生取代反应生成1molCH2Cl2,至少需要消耗2NA个Cl2分子
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2OCH3COOH+C2H5OH.已知该反应的速率随c(H+)的增大而加快。如图为CH3COOC2H5的水解速率随时间的变化图。下列说法正确的是( )
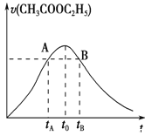
A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t0时反应达到平衡状态
D.tB时CH3COOC2H5的转化率低于tA时CH3COOC2H5的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)最近材料科学家发现了首例带结晶水的晶体在5K下呈现超导性。该晶体的化学式为Na0.35CoO2·1.3H2O(该晶体的摩尔质量为122g·mol-1),若用NA表示阿伏加德罗常数,则12.2g该晶体中含氧原子数为___,氢原子的物质的量为___mol。
(2)FeCl3溶液可以用来净水,用100mL2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数___(填“大于”“等于”或“小于”)0.2NA。
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=___mol/L(用以上字母表示,且必须化简)。
(4)工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应:NaClO2+HCl→ClO2↑+NaCl+H2O。写出配平的化学方程式____。
(5)向100mL的FeBr2溶液中通入标准状况下Cl23.36L(已知还原性:Fe2+>Br-),反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为____mol/L。反应的离子方程式为____。
(6)若向盛有10mL1mol·L-1NH4Al(SO4)2溶液的烧杯中加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O===Cu2O+2Ag,下列有关说法正确的是 ( )

A. 2 mol Cu与1 mol Ag2O的总能量低于1 mol Cu2O与2 mol Ag具有的总能量
B. 负极的电极反应式为2Cu+2OH--2e-===Cu2O+H2O
C. 测量原理示意图中,电流方向从Cu→Ag2O
D. 电池工作时,OH-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
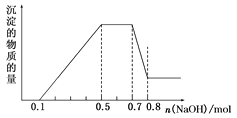
A.溶液中一定不含CO32-,可能含有SO42-和NO3-
B.在滴加NaOH溶液物质的量为0.5~0.7mol时,发生离子反应为Al3++4OH-=AlO2-+2H2O
C.溶液中的阳离子只有H+、Mg2+、Al3+
D.n(H+)∶n(NH4+)∶n(Mg2+)=2∶4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com