
科目: 来源: 题型:
【题目】配制VmL 2.0mol·L-1的氢氧化钠溶液,需要氢氧化钠固体质量______ g。 下列操作,会使所配的溶液浓度如何变化。
(1)称取氢氧化钠固体时将固体放在天平托盘的纸片上:______ ;
(2)称量时左码右物,且使用了游码:_______;
(3)容量瓶用蒸馏水洗净,没有烘干:________;
(4)没有等到溶液冷却到室温就将溶液注入容量瓶中:______;
(5)转移溶液时有溶液撒出:_____,
(6)没有用蒸馏水洗烧杯和玻璃棒:____,
(7)定容时仰视液面:_____,
(8)定容时俯视液面:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年4月26日,中田首艘国产航母在大连正式下水,标志着我国自主设计航空母舰取得重大阶段性成果。请回答下列问题:
(1)航母用钢可由低硅生铁冶炼而成。
①硅原子L能层的电子分布图为____________________;
②Fe3+比Fe2+稳定的原因是_____________________;
③铁氰化钾K3[Fe(CN)6]溶液可以检验Fe2+。1 mol CN-中含有π键的数为_________,与CN-互为等电子体的分子有__________(写出一种),铁氰化钾晶体中各种微粒间相互作用不包括_______________;
a. 离子键 b. 共价键 c.配位键 d. 金属键 e. 氢键 f. 范德华力
(2)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
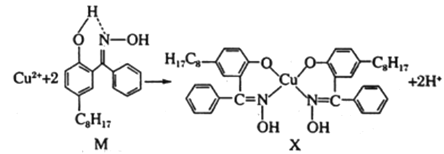
①M所含元素的电负性由大到小的顺序为__________(用元素符号表示);
②X中采用sp3杂化的非金属原子有___________(填写元素名称),采用sp3杂化的原子有__________个;
(3)Fe3O4是Fe3+、Fe2+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图所示,已知该晶体的晶胞参数为a nm,密度为b g/cm3,则NA=__________mol-1。(列出含a、b的计算式)
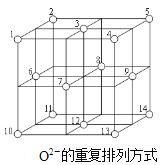 (白球表示O2-)
(白球表示O2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】与50 mL 0.1 mol·L-1的Na2CO3溶液中Na+的物质的量相同的溶液是( )
A.50 mL 0.2 mol·L-1的NaCl溶液B.100 mL 0.2 mol·L-1的NaCl溶液
C.25 mL 0.1 mol·L-1的Na2SO4溶液D.50 mL 0.1 mol·L-1的NaHCO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是红黄色有毒气体,有刺激性气味,沸点为11℃,极易溶于水但不与水反应,遇热水缓慢水解成次氯酸、氯气和氧气,见光也易分解,因此其溶液置于冷暗处相对稳定。某校合作学习小组的同学欲制备二氧化氯水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。
向圆底烧瓶中先加入10gKClO3固体和9gH2C2O4·2H2O(草酸),然后再加入5mL稀硫酸,用磁力搅拌器搅拌(如下图);将烧瓶放在热水浴中,保持水浴温度在60~80℃,至B中广口瓶内溶液呈深红黄色时停止加热。
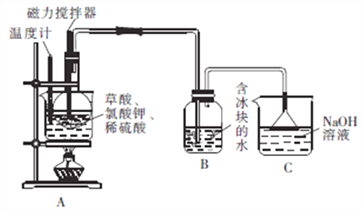
回答下列问题:
(1)装置A用水浴加热的优点是_________________;装置A中水浴温度不宜低于60℃也不宜高于80℃,其原因是______________________。
(2)装置A中反应生成ClO2及KHSO4等产物的化学方程式为_________________。
(3)装置B的水中需放入冰块的目的是_________________,装置C的作用是_______________
Ⅱ.设计实验验证ClO2的氧化性。
(4)取适量ClO2水溶液加入H2S溶液中,振荡,得无色溶液。欲检验H2S的氧化产物,还需要用到的试剂是_______________________。
(5)证明ClO2的氧化性比Fe3+强的方案是______________________。
(6)将少量ClO2水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,则该反应的离子方程式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】胶体金即金溶胶,其具有光吸收性、呈色性和胶体性等特点。免疫胶体金技术作为胶体金标记物, 可实现对抗原抗体的测定。

用白磷还原法可制得一种金的分散系,该分散系在临床诊断及药物检测等方面有着广泛的应用。
其操作步骤如下:
a.取20%白磷(①)的乙醚溶液0.5 mL,加蒸馏水(②)60 mL。
b.先滴加1%氯化金水溶液(③)0.75 mL,再滴加0.1 mol·L-1的K2CO3(④)0.6 mL,振荡变成棕红色。
c.加热煮沸至溶液变成透明红色。
d.分离提纯,除去无机溶质。
所得分散系中,金颗粒直径在5~12 nm之间。
请回答下列问题:
(1)上述物质①②③④中属于单质的是________(填序号,下同),属于化合物的是________,属于盐的是________。
(2)该分散系属于________,其分散质是_______________。
(3)所得红色溶液________(填“能”或“不能”)继续加热。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
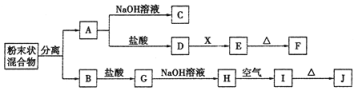
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃,向20 mL 0.1 mol·L1 MOH溶液中滴加0.1 mol·L1 CH3COOH溶液, 所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是
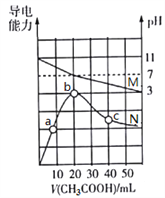
A. MOH是弱碱,其Kb=1.0×1021
B. b点溶液中,c(CH3COO)+ c(CH3COOH)=0.1 mol·L1
C. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO)>c(M+)>c(H+)>c(OH)
查看答案和解析>>
科目: 来源: 题型:
【题目】A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为___________________;若只能在加热情况下进行,则反应物A应为_______;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用的Li-CO2电池组成为钌电极/CO2-饱和LiClO4-DMSO电解液/锂片。下列说法正确的是
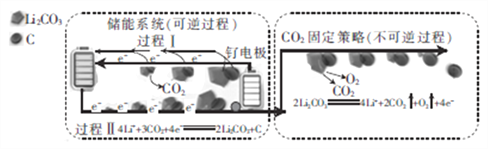
A. Li-CO2电池电解液由LiClO4和DMSO溶于水得到
B. CO2的固定中,每转移8mole-,生成3mol气体
C. 过程Ⅱ中电能转化为化学能
D. 过程Ⅰ的钌电极的电极反应式为2Li2CO3+C-4e-=4Li++3CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com