
科目: 来源: 题型:
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](C104)2}是一种新型的起爆药。
(1)Ni2+核外电子排布式为___。
(2)ClO4-空间构型是___;与ClO4-互为等电子体的一种分子为___(填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为___;C、N、O三种元素的电负性由大到小的顺序为___。
(4)高氯酸三碳酰肼合镍可由NiO、髙氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为___。

查看答案和解析>>
科目: 来源: 题型:
【题目】灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2,为了检验产物中的H2和CO(设气体均被充分吸收),设计如下实验装置。下列有关说法错误的是
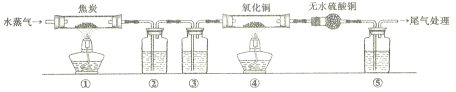
A. 为了实验安全,应先点燃①处酒精灯,后点燃④处酒精灯
B. ②、③、⑤中依次盛装氢氧化钠溶液、浓硫酸和澄清石灰水
C. ④中黑色固体变红色,即可证明产物中一定含有H2和CO中的一种或两种
D. 若用碱石灰替换无水硫酸铜,也可以达到检验H2和CO目的
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线。下列判断错误的是( )

A. ①线表示Al3+的物质的量的变化
B. x表示AlCl3的物质的量
C. ③线表示Al(OH)3的物质的量的变化
D. ④线表示[Al(OH)4]-的物质的量的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】四氢呋喃是常用的有机溶剂,可由有机物A(分子式:C4H8O)通过下列路线制得

已知:R1X + R2OH![]() R1OR2 + HX
R1OR2 + HX
下列说法不正确的是
A. C中含有的官能团仅为醚键 B. A的结构简式是CH3CH=CHCH2OH
C. D和E均能使酸性高锰酸钾溶液褪色 D. ①③的反应类型分别为加成反应、消去反应
查看答案和解析>>
科目: 来源: 题型:
【题目】香料G的一种合成工艺如下图所示:
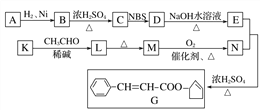
核磁共振氢谱显示A有两种峰,且峰面积之比为1∶1。
已知:CH3CH2CH===CH2![]() CH3CHBrCH===CH2
CH3CHBrCH===CH2
CH3CHO+CH3CHO![]() CH3CHOHCH2CHOCH3CHOHCH2CHO
CH3CHOHCH2CHOCH3CHOHCH2CHO![]() CH3CH===CHCHO+H2O
CH3CH===CHCHO+H2O
请回答下列问题:
(1)A的结简式为__________,G中官能团的名称为___________。
(2)检验M已完全转化为N的实验操作是____________________。
(3)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_______________。
(4)写出下列转化的化学方程式,并标出反应类型:
K→L:________________,反应类型:________。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有________种。(不考虑立体异构)
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上有2个对位取代基
(6)以丙烯和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)。________
请用以下方式表示:A![]() B…
B…![]() 目标产物
目标产物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是
A. 依据铝热反应原理,能发生反应2Al+3MgO![]() 3Mg+Al2O3
3Mg+Al2O3
B. 在加入铝粉能放出氢气的溶液中,K+、NH4+、CO32-、Cl-一定能够大量共存
C. 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D. 氯化铝溶液中加入过量氨水反应实质是:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
I.2015年国产C919大型客机正式下线,标志着我国成为世界上少数几个具有自行研制大型飞机的国家之一,标志着我国航空工业进入了新的发展阶段。
(1)飞机的外壳通常采用镁-铝合金材料,铝的价电子排布图为 ,第一电离能:镁 (填“大于”或“小于”)铝。
(2)现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料--玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如下图所示:


其中碳原子的杂化方式为 ,个数比为 。
II.大型飞机的发动机被誉为航空工业皇冠上的“宝石”。制造过程中通常采用碳化钨做关键部位的材料。
(3)钨元素位于周期表的第六周期第VIB族,请写出其外围电子排布式 ;
(4)下图为碳化钨晶体的一部分结构, 碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有 个,1个钨原子周围距离钨原子最近的碳原子有 个 ,下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是 。
A. Fe Cu B.Ti Au C.Mg Zn D.Cu Ag
(5)假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
2C(s)+O2(g)=2CO(g)△H3=-221kJ/mol
若某反应的平衡常数表达式为:K=[c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2min时体系压强为p1,则p1∶p0=__________。2~5min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)![]() NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。

①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)
查看答案和解析>>
科目: 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )
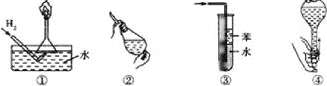
A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿的主要成分是A12O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取A12O3。

回答下列问题:
(1)沉淀物的化学式分别是:
![]() __________;d__________; f__________;
__________;d__________; f__________;
(2)写出加入过量NaOH溶液时所发生主要反应的离子方程式____________、________
(3)写出通入气体B(过量)时溶液C中发生反应的离子方程式___________、____________。
(4)气体B能否改用试剂A代替?为什么?_________,_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com