
科目: 来源: 题型:
【题目】我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气,原理如图所示。下列说法正确的是
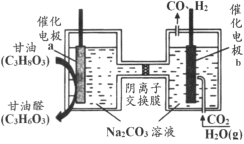
A.催化电极b与电源正极相连
B.电解时催化电极a附近的pH增大
C.电解时阴离子透过交换膜向a极迁移
D.生成的甘油醛与合成气的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】现对三种不同的镁铝合金样品进行编号,做以下实验探究。
(1)取样品①m1g,加入过量NaOH溶液,充分反应后过滤;往滤液中通入过量CO2气体:将所得沉淀过滤、洗涤、烘干,灼烧,得到固体的质量仍然为m1g.合金中镁的质量分数为_____(保留2位小数,下同)。
(2)取样品②m2g,与足量稀硫酸反应,固体完全溶解时得到气体的体积为VL(标准状况)。m2的取值范围是_____。
(3)取样品③0.918g与30.00mL、2.00mL盐酸充分反应后,得到672mL气体(标准状况)。剩余合金0.306g(认为合金中镁、铝与酸的反应同时发生)。然后在反应后所得体系中继续加1.00mol/L的NaOH溶液,恰好使所有铝元素均不以沉淀形式存在。则需要加入1.00mol/L的NaOH溶液_____mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的几种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如下实验:

下列判断正确的是
A.气体A一定是CO2,气体B一定是NH3
B.白色沉淀不可能是Al(OH)3
C.溶液中一定存在Al3+、Fe2+、NO3-、NH4+
D.溶液中一定不存在大量Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中不正确的是
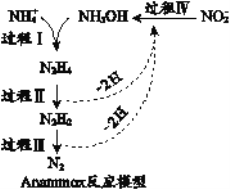
A. 1mol NH4+ 所含的质子总数为10NA
B. 联氨(N2H4)中含有极性键和非极性键
C. 过程II属于氧化反应,过程IV属于还原反应
D. 过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】三草酸合铁酸钾晶体(K3[Fe(C2O4)3]xH2O)(其中铁的化合价为+3价)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
Ⅰ.铁含量的测定
步骤1:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤2:取溶液25..00mL于锥形瓶中,酸化,滴加KMnO4溶液至草酸根(C2O42﹣)恰好全部被氧化成CO2,同时,MnO4﹣被还原成Mn2+;向反应后的溶液中加入锌粉至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被还原成Mn2+。
重复步骤2、步骤3操作,滴定消耗0.010mol/LKMnO4溶液19.98mL。
请回答下列问题:
(1)步骤2中加入锌粉至黄色刚好消失,目的是_____。
(2)写出步骤3中发生反应的离子方程式_____。
(3)根据实验数据,测得该晶体中铁元素的质量分数为_____。
(4)若步骤2中加入的KMnO4溶液的量不足,则测得的铁含量_____(选填“偏低”“偏高”或“不变”)
Ⅱ.结晶水的测定
(5)采用热重分析仪测定三草酸合铁酸钾晶体K3[Fe(C2O4)3]xH2O在110℃时的失重率为a%,则晶体
化学式中结晶水个数x的计算式为_____。(用含a的代数式表示)(已知:三草酸合铁酸钾的摩尔质量M(K3[Fe(C2O4)3])=437g/mol)
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置测定镁带样品中单质镁的质量分数。(杂质与酸反应不产生气体)
完成下列填空:
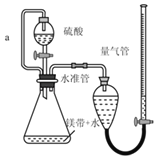
(1)硫酸必须过量的目的是_____
(2)导管a的作用是_____
(3)取两份镁带样品分别进行实验,所得数据见下表:
实验次数 | 镁带质量(g) | 氢气体积(mL)(已换算成标准状况) |
1 | 0.053 | 44.60 |
2 | 0.056 | 47.05 |
单质镁的质量分数是_____。(保留3位小数)
(4)如果测定结果偏高,可能的原因是_____。(选填编号)
a.装置漏气
b.未冷却至室温即读数
c.镁带中含有氧化镁
d.末读数时量气管的液面低于水准管
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.5mol CH4的质量是_____g,在标准状况下的体积为______L;含有约______个氢原子。
(2)将标准状况下22.4L的HCl溶于水配成200mL的溶液,所得溶液的物质的量浓度为______;配制300mL 0.5molL﹣1氯化钠溶液,需要1.5molL﹣1的氯化钠溶液的体积是______mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
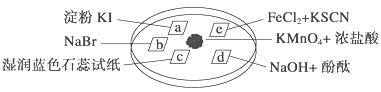
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列填空:
(1)氢氧化铝在碱性溶液中的电离方程式为_____。
(2)向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加用硫酸酸化过的H2O2,溶液变红。写出相应反应的离子方程式_____,_____。
(3)右为某烃的球棍模型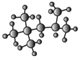 ,其名称(系统命名法)是_____
,其名称(系统命名法)是_____
以下写出相应的化学方程式
(4)铝粉与二氧化锰混合物在高温下反应_____
(5)氢氧化亚铁置于潮湿的空气中_____
(6)向已酸化的FeCl3溶液中加入铜粉_____
查看答案和解析>>
科目: 来源: 题型:
【题目】将3.6 g镁铝合金,投入到500 mL 2 mol/L的盐酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是( )
A.150 mLB.200 mLC.250 mLD.280 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com