
科目: 来源: 题型:
【题目】有甲乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入 6mol/L 的硫酸溶液,乙同学将电极放入 6mol/L 的氢氧化钠溶液中,如图所示:

(1)写出甲电池中正极的电极反应式___________________ ;
(2)写出乙池中负极的电极反应式: 负极:_____ 总反应的离子方程式:_________
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金 属,则构成负极材料的金属活泼
,则甲会判断出_____活动性更强,而乙会判断出_____活动性更强(填名称)
(4)由此实验,可得到如下哪些正确结论(_____)
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b. 镁的金属性不一定比铝的强
c. 该实验说明金属活动性顺序表已过时,已没有利用价值
d. 该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法__填 “可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________ (如 可靠,可不填)
查看答案和解析>>
科目: 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>______________。基态K+电子占据最高能级的电子云轮廓图为_____________形。
(2) NaBH4是有机合成中常用的还原剂,其中阴离子的键角为___________。
(3)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为___________、___________(填字母标号)。
A.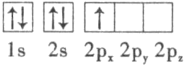 B.
B.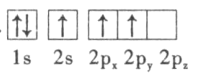
C. D.
D.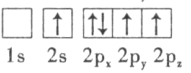
(4)硼元素的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。

①B2H6分子结构如图,则B原子的杂化方式为_________。
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是_______________,写出一种与氨硼烷互为等电子体的分子________________(填化学式)。
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。P的配位数为_____________,磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______________,已知晶胞边长为apm,则磷化硼晶体的密度是___________g·cm-3。
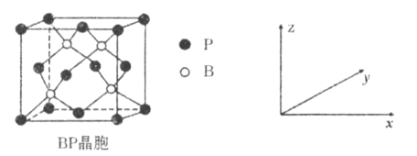
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示装置可用来制取和观察![]() 在空气中被氧化时的颜色变化,实验时必须使用铁屑、稀硫酸、
在空气中被氧化时的颜色变化,实验时必须使用铁屑、稀硫酸、![]() 溶液,其他试剂任选。
溶液,其他试剂任选。

完成下列填空:
(1)![]() 中盛有一定量的
中盛有一定量的![]() 溶液,烧瓶
溶液,烧瓶![]() 中应预先加入的试剂是______。
中应预先加入的试剂是______。![]() 中发生反应的离子方程式为____________。
中发生反应的离子方程式为____________。
(2)实验开始前应先将活塞![]() ______(填“打开”或“关闭”),其目的是______。
______(填“打开”或“关闭”),其目的是______。
(3) 简述生成![]() 的操作过程____________。
的操作过程____________。
(4)若拔掉装置![]() 中的橡胶塞,使空气进入,写出有关反应的化学方程式:____________。
中的橡胶塞,使空气进入,写出有关反应的化学方程式:____________。
请描述实验现象:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学做如下实验,以探究反应中的能量变化。
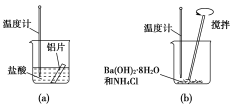
(1)在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是________热反应;(b)中温度降低,由此可以判断(b)中反应是________热反应。
(2)写出铝与盐酸反应的离子方程式:_______________。
(3)根据能量守恒定律,(b)中反应物的总能量应该________生成物的总能量。
查看答案和解析>>
科目: 来源: 题型:
【题目】锗(![]() )在自然界中非常分散,几乎没有比较集中的锗矿,因此被人们称为“稀散金属”。砷(
)在自然界中非常分散,几乎没有比较集中的锗矿,因此被人们称为“稀散金属”。砷(![]() )是第四周期VA族元素,可以形成
)是第四周期VA族元素,可以形成![]() 、
、![]() 、
、![]() 等化合物,用途广泛。完成下列填空:
等化合物,用途广泛。完成下列填空:
(1)已知锗元素与碳位于同一主族,与钙位于同一周期。
写出锗在周期表中的位置:____________。
根据锗在元素周期表中的位置写出锗的一条用途____________。
(2)将![]() 溶于浓盐酸,可以得到
溶于浓盐酸,可以得到![]() ,其沸点为
,其沸点为![]() 。
。
推测![]() 的晶体类型为______。
的晶体类型为______。
已知![]() 沸点高于
沸点高于![]() ,请从结构角度解释原因:____________。
,请从结构角度解释原因:____________。
将![]() 与
与![]() 作用可以得到
作用可以得到![]() ,
,![]() 水溶液呈______性(填“酸”“碱”或“中”)。
水溶液呈______性(填“酸”“碱”或“中”)。
(3)锗金属对人类具有保健功能,适宜人体接触佩戴。锗金属非常脆,容易破碎,一种常用的方法是将锗制成颗粒镶嵌到其他金属上,但存在易脱落的缺点。请提出一种改进建议:____________。
(4)砷原子核外有______个电子层,最外层有______个电子;比较溴、砷最高价氧化物对应水化物酸性的强弱:____________强于____________(填物质的化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】C、N的氧化物常会造成一些环境问题,科研工作者用各种化学方法来消除这些物质对环境的影响。回答下列问题:
(1)CO2的重整:用CO2和H2为原料可得到CH4燃料。
已知:①![]()
②![]()
写出CO2重整的热化学方程式___________________________。
200℃时,向VL恒温密闭容器A(恒容)、B(恒压)中,均充入1molCO2和4molH2,两容器中反应达平衡时放出或吸收的热量较多的是_________________(填“A”或“B”)。
(2)在恒容密闭容器中充入一定量的N2O4,发生可逆反应![]() 。则N2O4的平衡转化率随温度的变化曲线为右图中的______________(填“i”或“ⅱ”)曲线。若T2K时容器的起始压强为102kPa,则该温度下反应的分压平衡常数Kp=_____________kPa。
。则N2O4的平衡转化率随温度的变化曲线为右图中的______________(填“i”或“ⅱ”)曲线。若T2K时容器的起始压强为102kPa,则该温度下反应的分压平衡常数Kp=_____________kPa。

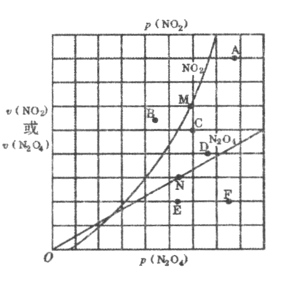
(3)反应![]() ,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是__________________________________。改变温度,v(NO2)会由M点变为A,B或C,v(N2O4)会由N点变为D,E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为____________(填字母标号)。
,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是__________________________________。改变温度,v(NO2)会由M点变为A,B或C,v(N2O4)会由N点变为D,E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为____________(填字母标号)。
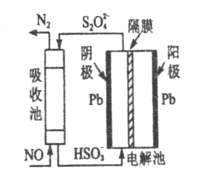
(4)间接电化学法除NO,其原理如图所示。写出阴极的电极反应式(阴极室溶液呈酸性)_____________________,吸收池中除去NO的原理_______________(用离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的定容密闭容器中,下列情况表明反应A(s)+2B(g)![]() C(g)+D(g) 已达到反应限度的是
C(g)+D(g) 已达到反应限度的是
A. 混合气体的密度保持不变B. 有1mol C生成的同时有1mol D生成
C. 混合气体的总物质的量保持不变D. 有1 mol A生成的同时有1mol C消耗
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种金属片在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:则四种金属的活泼性由强到弱的顺序为( )

A. Z>Y>X>WB. Z>X>Y>WC. Z>Y>W>XD. Y>Z>X>W
查看答案和解析>>
科目: 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+=-lgc(Ag+),其余离子类推。两条相交曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )
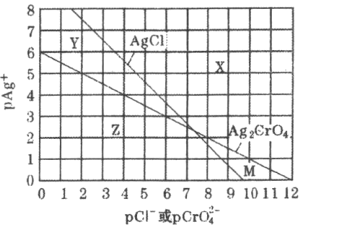
A.Ksp(Ag2CrO4)约为1×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Ag2CrO4,AgCl混合固体和水组成的溶解平衡体系中加入少量水,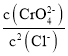 增大
增大
D.向Cl-,CrO42-均为0.1mol·L-1的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现一定量的铁铝合金与很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液![]() 中,逐滴加入
中,逐滴加入![]() 的氢氧化钠溶液,所加氢氧化钠溶液的体积(
的氢氧化钠溶液,所加氢氧化钠溶液的体积(![]() )与产生的沉淀的物质的量(mol)的关系如下图所示,则下列有关计算和判断正确的是( )
)与产生的沉淀的物质的量(mol)的关系如下图所示,则下列有关计算和判断正确的是( )
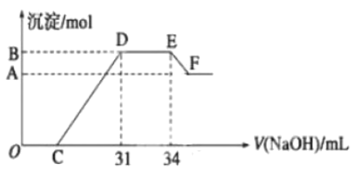
A.溶液![]() 中所含的阳离子有:
中所含的阳离子有:![]() 、
、![]() 、
、![]() 、
、![]()
B.在![]() 段,发生反应的离子方程式为
段,发生反应的离子方程式为![]()
C.无法求出![]() 点对应的沉淀的物质的量
点对应的沉淀的物质的量
D.![]() 点对应的氢氧化钠溶液的体积为
点对应的氢氧化钠溶液的体积为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com