
科目: 来源: 题型:
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂。请回答下列问题:
(1)基态Ni原子价层电子的轨道表达式为__________________。
(2)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(3)![]() 因具有良好的结构稳定性而成为新一代锂离子电池正极材料,这与
因具有良好的结构稳定性而成为新一代锂离子电池正极材料,这与![]() 的结构密切相关,
的结构密切相关,![]() 的立体构型为________,P、O、S的电负性从大到小的顺序为_____,
的立体构型为________,P、O、S的电负性从大到小的顺序为_____,![]() 过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是_____(填标号)。
过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是_____(填标号)。
A.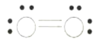 B.
B.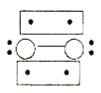 C.
C.![]() D.
D.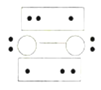
(4)![]() 易与
易与![]() 结合形成
结合形成![]() ,
,![]() 与
与![]() 间的化学键类型为________,若将配离子
间的化学键类型为________,若将配离子![]() 中的2个
中的2个![]() 换为
换为![]() ,2种结构,则
,2种结构,则![]() 是否为
是否为![]() 杂化________(填“是”或“否”),理由为_________________。
杂化________(填“是”或“否”),理由为_________________。
(5)金属锰有多种晶型,其中![]() 的结构为体心立方堆积,晶胞参数为apm。
的结构为体心立方堆积,晶胞参数为apm。![]() 中锰的原子半径为________pm。已知阿伏加德罗常数的值为
中锰的原子半径为________pm。已知阿伏加德罗常数的值为![]() ,
,![]() 的理论密度
的理论密度![]() ________
________![]() 。(列出计算式)
。(列出计算式)
查看答案和解析>>
科目: 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目: 来源: 题型:
【题目】钒是地壳中含量第21丰富元素,是人体必需的微量元素,对治疗糖尿病和癌症及保护心血管等具有潜在的药理学作用。工业上用含三价钒![]() 为主的某石煤为原料(含有
为主的某石煤为原料(含有![]() 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备![]() ,其流程如下:
,其流程如下:
![]()
已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 |
|
|
|
|
(1)焙烧:向石煤中加生石灰焙烧,将![]() 转化为
转化为![]() 的化学方程式是________________。
的化学方程式是________________。
(2)酸浸:![]() 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的![]() ,
,![]() 溶于盐酸的离子方程式是________________。
溶于盐酸的离子方程式是________________。
(3)转沉:将浸出液中的钒转化为![]() 固体,其流程如下:
固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是____________________________________。
②向![]() 溶液中加入
溶液中加入![]() 溶液,控制溶液的
溶液,控制溶液的![]() 。当
。当![]() 时,
时,![]() 的产量明显降低,原因是_______________________________________。
的产量明显降低,原因是_______________________________________。
(4)实验室以![]() 为原料还可以合成用于制备
为原料还可以合成用于制备![]() 的氧钒(IV)碱式碳酸铵晶体,过程如下:
的氧钒(IV)碱式碳酸铵晶体,过程如下:
![]()
①步骤ⅱ可在如图装置(气密性良好)中进行。已知:![]() 能被
能被![]() 氧化。
氧化。
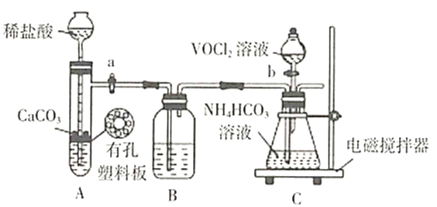
药品填装完成后的实验操作是________(填“活塞a”、“活塞b”的操作顺序),装置B中的试剂是________。
②测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加![]() 的
的![]() 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%![]() 溶液至稍过量,再用尿素除去过量的
溶液至稍过量,再用尿素除去过量的![]() ,最后用
,最后用![]() 的
的![]() 标准溶液滴定至终点,消耗体积为30.00mL(滴定反应:
标准溶液滴定至终点,消耗体积为30.00mL(滴定反应: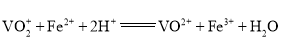 )。
)。
![]() 溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。
溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某研究小组拟设计微生物燃料电池将污水中的乙二胺![]() 氧化成环境友好的物质,再利用该装置模拟工业电解法来处理含
氧化成环境友好的物质,再利用该装置模拟工业电解法来处理含![]() 废水,电解过程溶液中发生反应为
废水,电解过程溶液中发生反应为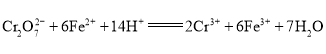 。当电池工作时,下列说法错误的是( )
。当电池工作时,下列说法错误的是( )

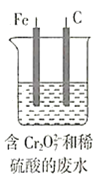
A.Fe棒应与N极相连
B.![]() 透过质子交换膜由右向左移动
透过质子交换膜由右向左移动
C.若溶液中减少了![]()
![]() ,则电路中至少转移
,则电路中至少转移![]() 电子
电子
D.M极电极反应式为H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
查看答案和解析>>
科目: 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目: 来源: 题型:
【题目】羟氨![]() 在水溶液中的电离方程式为:
在水溶液中的电离方程式为:![]() ,用0.1mol/L盐酸滴定20mL 0.1mol/L
,用0.1mol/L盐酸滴定20mL 0.1mol/L![]() 溶液,恒定25℃时,滴定过程中由水电离出来的OHˉ浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )
溶液,恒定25℃时,滴定过程中由水电离出来的OHˉ浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )

A.B点对应的溶液中![]()
B.C点对应的溶液中![]()
C.A到C溶液中,![]() 电离常数不变
电离常数不变
D.由A到D,水电离出的![]() 先减小后增大
先减小后增大
查看答案和解析>>
科目: 来源: 题型:
【题目】利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
(1)将褐色硬块处理成粉末状。研究小组首先排除了含有单质Al杂质的可能性,实验方法是________,证明不含单质铝的现象是_____________。
(2)该褐色硬块的组成基本确定为Fe、Fe2O3,Al2O3。请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20% KSCN、3 mol·L-1NaOH、3 mol·L-1HCl、3 mol·L-1HNO3、3 mol·L-1CuSO4、0.01 mol·L-1KMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。_____________。
实验操作 | 预期现象和结论 |
步骤1: | |
步骤2: | |
步骤3: | |
步骤4: |
查看答案和解析>>
科目: 来源: 题型:
【题目】冶炼金属常用以下几种方法:
①用碳、一氧化碳或氢气做还原剂还原;
②用较活泼金属钠、镁等还原;
③电解法;
④热分解法。
选用最佳方法将下列金属从其化合物中还原出来:
(1)铁、锌、铜等中等活泼金属________。
(2)钠、镁、铝等活泼或较活泼金属________。
(3)汞、银等不活泼金属________。
(4)钾、铷、铯、钛等金属通常还原方法是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
①该反应能否自发进行与________________有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是____________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。

a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com