
科目: 来源: 题型:
【题目】按照下图所示的操作步骤,完成氢氧化钠与盐酸的反应的实验。
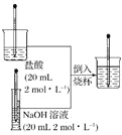
回答下列问题:
(1)反应后混合溶液的温度与反应前盐酸和氢氧化钠溶液的温度相比较其变化是___________________________________。
(2)你认为酸碱中和反应是放热反应还是吸热反应____________________________________。
(3)写出该反应的离子方程式:____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸氨柔比星是临床主要用于治疗癌症的药物。F是合成盐酸氨柔比星的三种中间体之一,其合成路线如下:

⑴化合物D的分子式为C12H14O2,请写出D的结构简式:______。
⑵写出同时满足下列条件的B的一种同分异构体的结构简式:_____。
Ⅰ.能发生银镜反应,且能与FeCl3溶液发生显色反应;
Ⅱ.分子中含有4种不同化学环境的氢。
⑶请写出以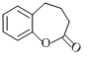 为原料制备
为原料制备![]() 的合成路线(无机试剂任选)。合成路线流程例见本题题干。____________________
的合成路线(无机试剂任选)。合成路线流程例见本题题干。____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】按照下图所示的操作步骤,完成Ba(OH)2·8H2O与氯化铵晶体反应的实验。
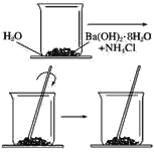
回答下列问题
(1)实验过程中观察到的现象是________________________。
(2)写出该反应的化学方程式___________________。
(3)该反应是放热反应还是吸热反应________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究物质的组成、结构有利于更好的理解物质的性质。
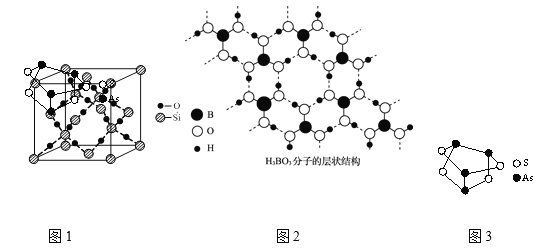
⑴图3是As4S4分子的结构,该分子中含非极性共价键的数目是_____;基态As原子的外围电子排布式是______。
⑵图1是某种晶体的晶胞,该晶体的化学式是______。
⑶图1对应物质与图3对应物质熔点较高的是______,原因是______。
⑷NaCl的熔点为801.3℃,MgO的熔点高达2800℃。MgO熔点高的原因是______。
⑸图3所示是硼酸晶体的层状结构,层内H3BO3分子通过氢键相连。H3BO3分子B原子的轨道杂化方式是______,1 mol H3BO3晶体中含有的氢键数目是_____。
⑹金刚石、晶体硅、金刚砂(SiC)的晶体类型相同,它们的熔点由高到低的顺序是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是人类最早使用的金属之一,铜的化合物丰富多彩。
⑴铜与N2O4在一定条件下可制备无水Cu(NO3)2。Cu在周期表中位于______区,基态Cu原子的电子排布式为______。NO3-的空间构型为_____。
⑵邻氨基吡啶(![]() )的铜配合物在有机合成中有重要作用。 C、N、O的第一电离能由大到小的顺序为______;邻氨基吡啶的铜配合物结构简式如图所示,C原子轨道杂化类型为______;1 mol
)的铜配合物在有机合成中有重要作用。 C、N、O的第一电离能由大到小的顺序为______;邻氨基吡啶的铜配合物结构简式如图所示,C原子轨道杂化类型为______;1 mol ![]() 中σ键的数目为______mol。
中σ键的数目为______mol。
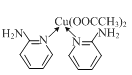
⑶如图是铜的一种氮化物晶体的晶胞结构。该化合物中Cu的化合价是______,Cu和N原子的配位数之比是______。

查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾是一种重要的氧化剂,某化学实验小组制备高锰酸钾并测其纯度的步骤如下,请回答相关问题:
![]()
Ⅰ.高锰酸钾的制备
(1)将![]() 和
和![]() 固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入
固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入![]() 粉末,不断搅拌,呈颗粒状后,再加强热
粉末,不断搅拌,呈颗粒状后,再加强热![]() 得墨绿色产物(
得墨绿色产物(![]() 为墨绿色固体),冷却。
为墨绿色固体),冷却。
①制![]() 反应的化学方程式为____。
反应的化学方程式为____。
②实验中使用的坩埚及搅拌棒的材质可以是________。
A.石英 B.瓷 C.刚玉(氧化铝) D.铁
(2)取出墨绿色产物研细,每次用![]() 4%的热
4%的热![]() 溶液浸取,过滤后对滤渣重复浸取两次。合并三次浸取液,得墨绿色溶液。将墨绿色产物研细并分三次浸取,这样做的目的是_________。
溶液浸取,过滤后对滤渣重复浸取两次。合并三次浸取液,得墨绿色溶液。将墨绿色产物研细并分三次浸取,这样做的目的是_________。
(3)![]() 在水溶液中会发生歧化反应:
在水溶液中会发生歧化反应:![]() ,通入
,通入![]() 气体可促进反应趋于完全。向(2)制得的墨绿色溶液中连续通入
气体可促进反应趋于完全。向(2)制得的墨绿色溶液中连续通入![]() 气体至溶液
气体至溶液![]() 在10~11之间,过滤。滤液中的溶质除
在10~11之间,过滤。滤液中的溶质除![]() 外,还主要含有_____。
外,还主要含有_____。
(4)将滤液转入蒸发皿,小火加热,当看到________的现象时停止加热,冷却,________、________,干燥后得![]() 粗品。
粗品。

Ⅱ.高锰酸钾纯度的测定
(5)称取![]() 粗品,加入煮沸并冷却后的稀硫酸配成
粗品,加入煮沸并冷却后的稀硫酸配成![]() 溶液。量取
溶液。量取![]() 的草酸(
的草酸(![]() )溶液于锥形瓶中,用所配
)溶液于锥形瓶中,用所配![]() 溶液进行滴定。重复滴定两次,平均消耗
溶液进行滴定。重复滴定两次,平均消耗![]() 溶液的体积为
溶液的体积为![]() 。
。
①滴定开始时,溶液颜色褪去较慢,随后加快,原因是________。
②滴定终点的标志是___________。
③![]() 纯度(质量分数)的计算式为________。
纯度(质量分数)的计算式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:![]() 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为![]() 。
。
回答下列问题:
(1)![]() 发生裂变反应:
发生裂变反应:![]() ,净产生的中子(
,净产生的中子(![]() )数为________。基态
)数为________。基态![]() 原子的外围电子排布式为
原子的外围电子排布式为![]() ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(2)![]() 和
和![]() 中,沸点较高的为________,与
中,沸点较高的为________,与![]() 形成的配离子稳定性较高的为________。
形成的配离子稳定性较高的为________。
(3)![]() 中存在大
中存在大![]() 键,形成该大
键,形成该大![]() 键的电子数为________。
键的电子数为________。
(4)某种铀氮化物的晶体结构与![]() 相同。
相同。![]() 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
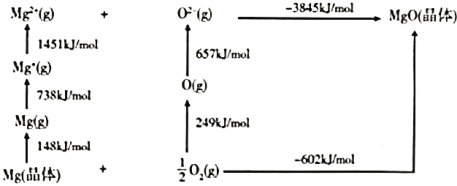
①![]() 晶格能为________
晶格能为________![]() 。
。
②![]() 的第二电离能大于
的第二电离能大于![]() 的第二电离能,是由于
的第二电离能,是由于![]() 的半径较
的半径较![]() 小、
小、![]() 的核电荷更高以及_______。
的核电荷更高以及_______。
(5)另一种铀氮化物的晶胞如下图所示,![]() “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
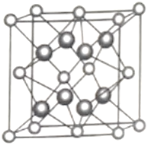
①铀元素的化合价为________,![]() “原子”的配位数为________。
“原子”的配位数为________。
②已知晶胞参数为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)。
(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 资源化利用的方法之一是合成二甲醚(
资源化利用的方法之一是合成二甲醚(![]() 简写做
简写做![]() )。
)。![]() 催化加氢法合成
催化加氢法合成![]() ,其过程中主要发生下列反应:
,其过程中主要发生下列反应:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
其中,反应Ⅱ分以下两步完成,请写出反应Ⅳ的热化学方程式。
反应Ⅲ:![]()
![]()
反应Ⅳ:___________。
⑴反应Ⅳ的热化学方程式为________。
⑵在![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 的平衡转化率和平衡时
的平衡转化率和平衡时![]() 、
、![]() 的选择性随压强或温度的变化见下图。已知:
的选择性随压强或温度的变化见下图。已知:
![]() 的选择性
的选择性![]() ;
;
![]() 的选择性
的选择性![]()
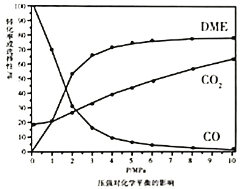

①依据图像中的数据分析,提高平衡时![]() 的选择性应当选择的条件为________。
的选择性应当选择的条件为________。
A 高温高压 B 低温低压 C 高温低压 D 低温高压
按照温度对化学平衡的影响图像分析温度低于300℃,![]() 平衡转化率随温度升高而降低的原因是_______。
平衡转化率随温度升高而降低的原因是_______。
②某温度和压强下,起始投入![]() 与足量
与足量![]() 发生反应,达到平衡时
发生反应,达到平衡时![]() 的转化率为40%,部分物质的物质的量如下表:
的转化率为40%,部分物质的物质的量如下表:
|
|
|
|
|
|
计算平衡时![]() 的选择性为________,反应Ⅳ的化学平衡常数为________。
的选择性为________,反应Ⅳ的化学平衡常数为________。
⑶经研究发现,在不同反应条件下反应相同时间(未平衡)测定发现,体系中![]() 的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
⑷![]() ,投料比为
,投料比为![]() 时进行反应,
时进行反应,![]() 的浓度随时间变化如下图所示,则下列说法正确的为________。
的浓度随时间变化如下图所示,则下列说法正确的为________。
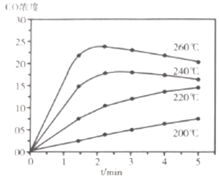
A 在![]() 范围内,反应Ⅰ的速率随温度升高而增大
范围内,反应Ⅰ的速率随温度升高而增大
B 200℃条件下,随反应时间的延长,![]() 的浓度始终增大
的浓度始终增大
C 260℃条件下,随反应时间的延长,![]() 的浓度先增大后减小最终不变
的浓度先增大后减小最终不变
D 260℃条件下,![]() 后
后![]() 的浓度减小是因为随时间推移反应Ⅱ的进行使体系中
的浓度减小是因为随时间推移反应Ⅱ的进行使体系中![]() 浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使
浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使![]() 浓度逐渐下降
浓度逐渐下降
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
⑴Fe3+可以与SCN-、CN-、有机分子等形成配合物。基态Fe3+的电子排布式为______;与SCN-互为等电子体且为非极性分子的化学式为______。
⑵化合物FeCl3是棕色固体、易潮解、100℃左右时升华,它的晶体类型是______。
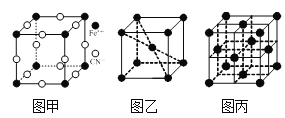
⑶普鲁士蓝俗称铁蓝,结构如图甲所示(K+未画出),平均每两个立方体中含有一个K+,该晶体的化学式为______。又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为______。
⑷在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为______,两种晶体中空间利用率较高的是______。(填“图乙”或“图丙”)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃条件下,向![]() 的盐酸中不断通
的盐酸中不断通![]() ,该过程中水电离出的氢离子浓度
,该过程中水电离出的氢离子浓度![]() 水
水![]() 与通入
与通入![]() 的物质的量关系如图,下列说法不正确的是( )。
的物质的量关系如图,下列说法不正确的是( )。
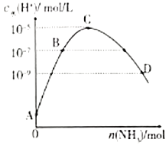
A.![]() 点的纵坐标为
点的纵坐标为![]()
B.![]() 点溶液中
点溶液中![]()
C.![]() 点溶液中
点溶液中![]()
D.![]() 点溶液的
点溶液的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com