
科目: 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
科目: 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
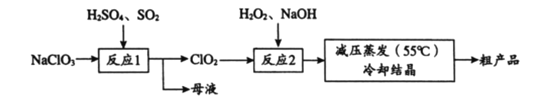
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯是重要的化工原料,以丙烯为原料合成有机玻璃和油墨材料DAP-A树脂的流程如下:
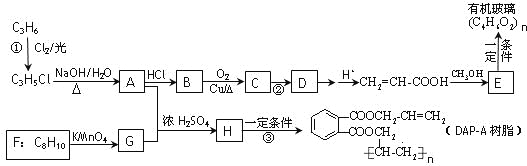
回答问题:
(1)写出下列物质可能的结构简式:B___________________,F________________________。
(2)写出反应类型:反应②___________________;反应③____________________________。
(3)1 mol DAP-A树脂在一定条件下与H2发生加成反应,最多消耗H2_______________mol。
(4)写出反应①的化学方程式_____________________________________________________。
(5)写出G在一定条件下与乙二醇发生反应生成一种高分子化合物的化学方程式为_______。
(6)E的同分异构体中,属于酯类的链状有机物有HCOOCH2CH=CH2、HCOOCH=CHCH3、___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知实验室以乙醇为原料来制备乙酸乙酯时,经历了下面三步反应:
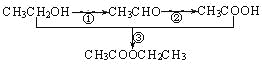
下列说法正确的是
A.乙醇和乙醛能发生氧化反应,乙酸和乙酸乙酯则不能被氧化
B.上述①、②、③的反应类型分别是氧化反应、加成反应和取代反应
C.上述乙醇、乙酸和乙酸乙酯都具有同分异构体
D.工业上可以通过石油分馏的方法获得乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 用Na2S处理含Hg2+废水:Hg2+ + S2 = HgS↓
B. 燃煤中添加生石灰减少SO2的排放:2CaO + O2 + 2SO2 ![]() 2CaSO4
2CaSO4
C. 工业上将Cl2 通入石灰乳中制漂白粉:Cl2 + OH- = Cl-+ ClO- + H2O
D. 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO-+ Cl-+2H+ = Cl2↑+ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示的两种有机物都由碳、氢、氧三种元素组成,下列叙述不正确的是( )

A.①和②都含有官能团羟基B.①和②具有相似的化学性质
C.①和②为同系物D.①和②所含氧元素的质量分数相同
查看答案和解析>>
科目: 来源: 题型:
【题目】利用煤化工所得的苯可合成甲苯、乙苯、环己烷,其反应如下:
①![]() +CH3Cl
+CH3Cl![]() (甲苯)+HCl
(甲苯)+HCl
②CH2=CH2+![]()
![]()
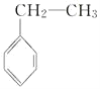 (乙苯)
(乙苯)
③![]() +3H2
+3H2![]()
![]()
下列说法正确的是( )
A.反应①、②、③均属于加成反应
B.溴水中加入苯,二者可发生取代反应
C.乙苯中所有碳原子一定在同一平面上
D.能用溴水判断反应②所得的乙苯中是否混有乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法不正确的是:
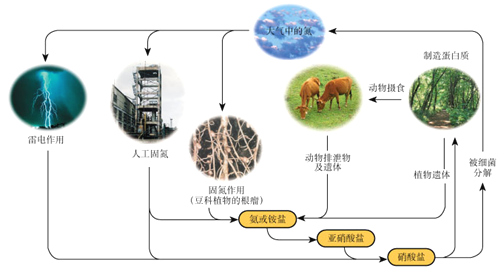
A. 氮元素均被氧化
B. 工业合成氨属于人工固氮
C. 含氮无机物和含氮有机物可相互转化
D. 碳、氢、氧三种元素也参与了氮循环
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、
、![]() 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
(1)基态Cr原子的未成对电子数为________________。
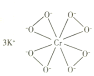
(2)![]() 的结构如图所示。
的结构如图所示。
①下列有关![]() 的说法正确的是__________(填标号)。
的说法正确的是__________(填标号)。
A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,![]() 。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
。氧的第一电子亲和能E1为__________kJ/mol;△H2>0,其原因是_____________________________________。
(3)雷氏盐的化学式为![]() 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为__________________。
②其阳离子的中心原子的杂化方式为_________________,配体之一NH3分子的立体构型为______。
③与配体NCSˉ互为等电子体的阴离子有![]() 等,分子有_____________________(写1种);画出
等,分子有_____________________(写1种);画出![]() 的结构式:_____________________________。
的结构式:_____________________________。
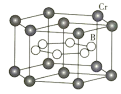
(4)![]() 的晶体密度为
的晶体密度为![]() ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为![]() ,高为
,高为![]() ,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
,设阿伏加德罗常数的值为NA,则a2c=_______________(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用真空碳热还原冶炼镁、铝及锰的单质或合金是治金工业的热点之一。回答下列问题:
(1)已知体系自由能变化![]() 时反应能自发进行。
时反应能自发进行。![]() 真空碳热还原冶炼镁的主要反应为
真空碳热还原冶炼镁的主要反应为![]() ,其自由能变化与温度、压强的关系如图所示:
,其自由能变化与温度、压强的关系如图所示:

温度由低到高的顺序是_______________,![]() 时该反应不能自发进行的温度是_________(填“
时该反应不能自发进行的温度是_________(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 提出的碳热还原
提出的碳热还原![]() 冶炼
冶炼![]() 的机理如下:
的机理如下:
(Ⅰ)![]()
(Ⅱ)![]()
(Ⅲ)![]()
则反应![]() 的
的![]() ______________
______________![]() (用含a、b、c的代数式表示);中间体之一
(用含a、b、c的代数式表示);中间体之一![]() 与
与![]() 反应可用于实验室制备甲烷,写出
反应可用于实验室制备甲烷,写出![]() 与
与![]() 反应的化学方程式:_________________________________________________________。
反应的化学方程式:_________________________________________________________。
(3)制备锰合金的相关反应及平衡时![]() 与温度的关系如图所示(
与温度的关系如图所示(![]() 为用分压表示的平衡常数,分压=总压×体积分数):
为用分压表示的平衡常数,分压=总压×体积分数):
(Ⅰ)![]()
(Ⅱ)![]()
(Ⅲ)![]()
①![]() 的反应是___________(填标号)。
的反应是___________(填标号)。
②![]() ____________[用
____________[用![]() 、
、![]() 表示];A点
表示];A点![]() ___________用[
___________用[![]() 表示]。
表示]。
③向某恒容密闭容器中充入![]() 并加入足量
并加入足量![]() ,若只发生反应:
,若只发生反应:![]() ,达到B点的平衡状态。达到平衡前,v(正)__________v(逆)(填“大于”“小于”或“等于”),达到平衡时,
,达到B点的平衡状态。达到平衡前,v(正)__________v(逆)(填“大于”“小于”或“等于”),达到平衡时,![]() _______________(保留小数点后两位)。
_______________(保留小数点后两位)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com