
科目: 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是研究铜与浓硫酸的反应装置:
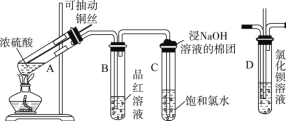
(1)A试管中发生反应的化学方程式为__________
(2)反应一段时间后,可观察到B试管中的现象为___________________
(3)C试管口浸有NaOH溶液的棉团作用是_________________
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是__________、__________。(要求填一种化合物和一种单质的化学式;如有需要,可加装防倒吸装置)
(5)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是___________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):

取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是______________________________________________。
(2)C装置的作用是__________________________________________;
D装置的作用是_____________________________________________。
(3)通过该实验,能否确定A中是否含有氧原子?________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.99 g,D装置增重26.4 g,则A分子式为____________。
(5)写出A燃烧的化学方程式_____________________________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)
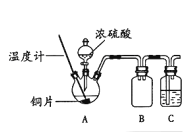
实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是________;装置C中盛放的试剂是_______。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是___________。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是_________。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+,补充的实验操作及现象是______。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有固体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中_______。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】烟气中SO2和NOx(NO及NO2)的脱除对于环境保护意义重大。
(1)湿式氨法烟气脱硫脱氮是通过氨水吸收烟气,得到含![]() 、
、![]() 、
、![]() 、
、![]() 和NO2的吸收液。
和NO2的吸收液。
①用离子方程式解释吸收液中含有![]() 的原因:_____________;
的原因:_____________;
②吸收液中的![]() 、
、![]() 均对NO2具有吸收作用,但
均对NO2具有吸收作用,但![]() 对NO2的吸收能力比
对NO2的吸收能力比![]() 弱,
弱,![]() 与NO2反应生成
与NO2反应生成![]() 的离子方程式是:___________;
的离子方程式是:___________;
(2)经测定,在烟气的吸收过程中,吸收液对NO2的吸收率随烟气通入量变化的曲线如下图所示。

结合化学用语解释产生上述结果的原因:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】选择性催化还原是在有催化剂的条件下将NOx转变为N2和H2O,这是目前国外硝酸厂进行尾气治理普遍采用的一种方法,某小组同学拟验证NO能被氨气还原并测算其转化率。

请回答下列问题:
(1)若制取氨气用A装置,则发生反应的化学方程式为_______,若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是______、________;
(2)用C装置制取NO时,用可抽动的铜丝,其优点是_______,其反应的离子方程式为________;
(3)装置⑦的作用可能是____________;
(4)若进入装置⑤的NO共2688mL(标况下),氨气过量,最后收集到标况下2016mLN2,则NO的转化率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿(CuFeS2)是制铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是_____(填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是_____(填代号)
a.高空排放b.用于制备硫酸c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:![]() +2I-=2
+2I-=2![]() +I2
+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程___、___
查看答案和解析>>
科目: 来源: 题型:
【题目】在100ml pH=1的硫酸溶液中,加入多少毫升0.01mol·L-1的NaOH溶液,才能使混合液的pH=2?(假设溶液体积不变)______________ mL
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,某气态烷烃和烯烃(含一个双键)的混合气体2.24 L完全燃烧后,将产生的气体缓慢通过浓硫酸,浓硫酸增重4.05 g,剩余气体通过碱石灰,碱石灰增重6.60 g。另再取2.24 L标准状况下的该混合气体,将它通入过量的溴水中,溴水增重1.05 g。
(1)确定混合气体由哪两种烃组成_______。
(2)计算混合气体中两种烃的体积分数_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com