
科目: 来源: 题型:
【题目】盐酸是中学化学常用的试剂,以下两个实验均和盐酸有关。
I.用密度为1.25 g·mL-1,质量分数36.5%的浓盐酸配制500 mL 0.20 mol·L-1盐酸溶液,请回答下列问题:
(1)浓盐酸的物质的量浓度为____________。
(2)配制500 mL 0.20 mol·L-1盐酸需要用量筒量取上述浓盐酸_______mL。
(3)对配制的盐酸测定,发现物质的量浓度小于0.2 mol·L-1,引起该误差的操作___(填序号)
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.用量筒量取浓盐酸时,仰视刻度线量取浓盐酸
C.定容时,仰视容量瓶刻度线进行定容
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,又滴加水至刻度处
Ⅱ.某学生设计如下图所示的实验装置,利用浓盐酸与高锰酸钾反应产生的氯气与熟石灰反应制取少量漂白粉,并探究氯、溴、碘的相关性质。请回答下列问题:

(4)A装置名称为________。
(5)漂白粉将在C装置的U形管中产生,写出生成漂白粉的化学方程式_______________。
(6)E装置中装有KI与CCl4混合液,向D中缓缓通入一定量氯气后,打开D装置中活塞,将D中少量溶液滴加入E装置中,振荡,观察到下层呈紫红色,由此得出结论:Br2置换出了I2,有同学对该结论提出异议,可能的理由是__________________________。
(7)F装置的作用是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯胺为无色液体,还原性强,易被氧化,有碱性,与酸反应生成盐,硝基苯与氢气制备苯胺(沸点为184℃)的反应原理如下:
 +3H2
+3H2![]()
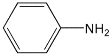 +2H2O
+2H2O
某同学设计的制备实验装置(部分夹持装置省略)如图:

下列说法正确的是( )
A.仅用上述装置图中仪器就可以完成该实验
B.用硝酸代替盐酸,反应速率更快,实验效果较好
C.点燃酒精灯前,打开K,先通一段时间的H2
D.三颈烧瓶内的反应结束后,关闭K,先在三颈烧瓶中加入浓硫酸后蒸馏
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A.C的生成速率与C分解的速率相等
B.单位时间生成nmolA,同时生成3nmolB
C.单位时间生成B的速率,与生成C的速率相等(数值)
D.单位时间消耗nmolA,同时生成2nmolC
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式书写正确的是( )
A.NO2通入NaOH浓溶液中:2NO2+2OH-=NO![]() +NO
+NO![]() +H2O
+H2O
B.(CH3COO)2Pb溶液中滴入稀硫酸:Pb2++SO![]() =PbSO4↓
=PbSO4↓
C.NaAlO2溶液中加入少量盐酸:AlO![]() +4H+=Al3++2H2O
+4H+=Al3++2H2O
D.NH4HSO3溶液中加入少量Ba(OH)2溶液:HSO![]() +Ba2++OH-=BaSO3↓+H2O
+Ba2++OH-=BaSO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)请写出指定物质对应的化学式。消毒剂碘伏中含有碘分子_____________,胶卷中必不可少的感光材料_____________,加碘盐中含有碘酸钾_____________,发酵粉含有小苏打_____________。
(2)化工厂镁着火,不能用二氧化碳灭火,用化学方程式解释__________________________。
(3)电解饱和食盐水是氯碱工业的基础,写出化学方程式__________________________。
(4)稀醋酸处理热水瓶中水垢(主要成分为碳酸钙)的离子方程式__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】
(1)含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的热化学方程式为___________________________,
表示该反应中和热的离子方程式为_________________________________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式__________________________________。
(3)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1 648 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393 kJ/mol
2Fe(s)+2C(s)+3O2(g)===2FeCO3(s) ΔH=-1 480 kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
_________________________________________________________________。
(4)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为______________________________________________。
(5)已知反应2HI(g)===H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为________________kJ。
(6)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。

查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.50 g 34%H2O2溶液中含H-O键的数目为NA
B.180 g淀粉完全水解生成葡萄糖的分子数为NA
C.1 L 0.1 mol·L-1K2SiO3溶液中含SiO32-的数目为0.1NA
D.反应5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O,每生成1 mol ClO2转移电子的数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸组成.核苷酸的单体由五碳糖 、磷酸基和含氮碱基构成.下列说法错误的是
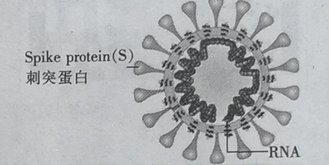
A.蛋白质和核酸均是高分子化合物
B.蛋白质中含C、H、O、N 等元素
C.五碳糖( C5H10O5)与葡萄糖互为同系物
D.NaClO溶液用作消毒剂,是因为NaClO 能使病毒蛋白变性
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的 ΔH________0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B, 反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,再次达平衡时A的转化率 ________(填“增大”、“减小”或“不变”);
(3)下列选项可作为判断该反应达到平衡的依据是______:
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200 ℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= __________,已知:K3000C>K3500C,则该反应是______热反应。
(2)图中表示NO2的变化的曲线是_____________;用O2表示从0~2 s内该反应的平均速率v=____________
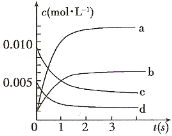
(3)能说明该反应已达到平衡状态的是____________ 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____________
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)关于该反应的下列说法中,正确的是________(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com