
科目: 来源: 题型:
【题目】香料甲和G都在生活中有很多用途,其合成路线如下:
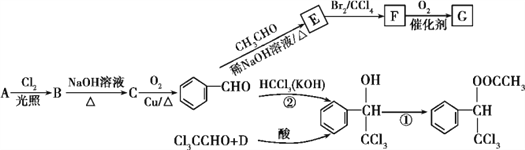
已知:①R1—CHO+R2—CH2—CHO![]()
![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。
(1)A的名称是____,G中含氧官能团的名称是____。
(2)②的反应类型是____,B和F的结构简式分别为______、______。
(3)写出一种能鉴别A和D的试剂:______;C有多种同分异构体,其中属于芳香族化合物的有____种。
(4)写出反应①的化学方程式:_____________。
(5)G的同分异构体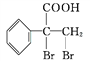 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_________。
为原料设计它的合成路线(其他所需原料自选)_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在![]() H、
H、![]() H、
H、![]() H、
H、![]() Mg、
Mg、![]() Mg和
Mg和![]() Cu中共有____种元素,_____种原子。
Cu中共有____种元素,_____种原子。
(2)有下列各组物质:A.O2和O3 B.12C和13C C.CH3—CH2—CH2—CH3和![]() D.
D.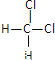 和
和 E.甲烷和庚烷。
E.甲烷和庚烷。
①_________组两物质互为同位素。
②__________组两物质互为同素异形体。
③_________组两物质属于同系物。
④_________组两物质互为同分异构体。
⑤_________组中两物质是同一物质。
查看答案和解析>>
科目: 来源: 题型:
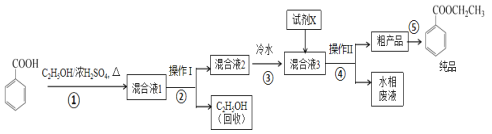
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如图:
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为__。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2h。仪器A的作用是__。

(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为__。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_;操作II所用的玻璃仪器除了烧杯外还有__。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有__;加入试剂X为___(填写化学式)。
(6)最终得到产物纯品10.0g,实验产率为__%(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为__;基态Mn原子核外有__个未成对电子,M层的电子云有__种不同的伸展方向。金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用“__理论”解释。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是__。
(3)NO![]() 与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。配位体NO
与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。配位体NO![]() 的中心原子的杂化形式为__,空间构型为__。大π键可用符号
的中心原子的杂化形式为__,空间构型为__。大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为![]() ,则NO
,则NO![]() 中大π键应表示为__。
中大π键应表示为__。
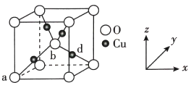
(4)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d点的坐标参数为__,已知该晶体的密度为ρgcm-3,NA是阿伏伽德罗常数的值,则晶胞参数为__pm。
),则d点的坐标参数为__,已知该晶体的密度为ρgcm-3,NA是阿伏伽德罗常数的值,则晶胞参数为__pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
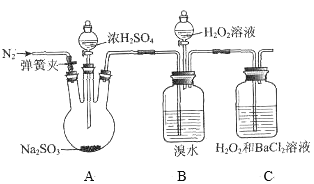
实验操作 | 实验现象 |
ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
ⅲ.打开B中分流漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是____。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是____。
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是___。
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)ⅲ中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br―
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是________。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,反应H2(g)+I2(g)![]() 2HI(g)达到化学平衡状态的标志是
2HI(g)达到化学平衡状态的标志是
A. 单位时间内生成nmolH2,同时就有nmolHI 生成
B. 单位时间内有nmolH2生成,同时就有nmolI2生成
C. 容器内气体的总压强不随时间的变化而变化
D. 容器内混合气体的颜色不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
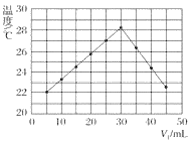
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。回答下列问题。
(1)已知:I.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) ΔH=-238kJ·mol-1
II.2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g)![]() C3H6(g)+H2(g)的ΔH为___。
C3H6(g)+H2(g)的ΔH为___。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。
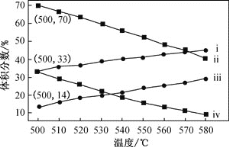
104Pa时,图中表示丙烯的曲线是__(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
(3)一定温度下,向恒容密闭容器中充入1molC3H8,开始压强为pkPa,发生丙烷脱氢制丙烯反应。
①下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是__(填字母)。
A.该反应的焓变(ΔH)保持不变
B.气体平均摩尔质量保持不变
C.气体密度保持不变
D.C3H8分解速率与C3H6消耗速率相等
②欲使丙烯的平衡产率提高,应采取的措施是__(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
③为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则丙烷脱氢反应的K__(填“增大”、“减小”或“不变”)
(4)丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图a所示。此温度下该反应的平衡常数Kp=__kPa(用含字母p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×物质的量分数)。
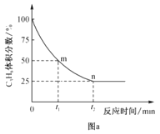
(5)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
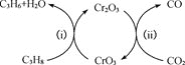
图中催化剂为__。该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com