
科目: 来源: 题型:
【题目】绿原酸(C16H18O9)具有较广泛的抗菌、抗病毒、抗氧化作用,利用乙醚、60%乙醇浸泡杜仲干叶,得到提取液,进一步获得绿原酸粗产品的一种工艺流程如图,下列说法错误的是( )
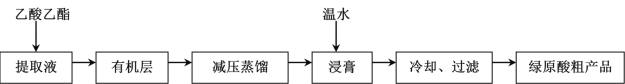
A.绿原酸在温水中的溶解度小于冷水中的溶解度
B.得到有机层的实验操作为萃取分液
C.减压蒸馏的目的防止温度过高,绿原酸变质
D.绿原酸粗产品可以通过重结晶进一步提纯
查看答案和解析>>
科目: 来源: 题型:
【题目】现有短周期元素R、X、Y、Z、T。R与T原子最外层电子数均是电子层数的2倍;Y元素能与大多数金属和非金属元素形成化合物;Z+与Y2-电子层结构相同。五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是

A. Y、Z组成的化合物只含离子键
B. 氢化物的沸点:Y < X
C. T、R的最高价氧化物对应的水化物的酸性T比R的强
D. Y分别与T、X组成的二元化合物的水溶液一定是强酸
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。25℃时,向浓度均为0.01mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____________沉淀(填化学式),生成该沉淀的离子方程式为______________,当两种沉淀共存时,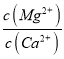 __________(保留两位有效数字)。
__________(保留两位有效数字)。
(2)25℃时,向0.01mol/L的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为____________;当溶液中的离子浓度小于1×10-5mol/L时,认为该离子沉淀完全,当Mg2+完成沉淀时,溶液的pH为___________ (忽略溶液体积的变化,已知:![]() 。
。
(3)该温度下,反应Cu(OH)2+2H+![]() Cu2++2H2O的平衡常数K=_____________。
Cu2++2H2O的平衡常数K=_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某同学探究硫代硫酸钠与酸反应速率的影响因素,设计了一系列如下实验:
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL-1) | V/mL | c/(molL-1) | V/mL | ||
A | 10 | 5 | 0.1 | 5 | 0.1 | 5 |
B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
C | 30 | 5 | 0.1 | 5 | 0.1 | 5 |
D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
(1)实验过程中为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率大小________________________。
(2)若要探究温度对反应速率的影响,可以选择实验中的哪些组合来比较_______(填组号)。
(3)利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可定量测定市售硫代硫酸钠的纯度,现称硫代硫酸钠固体样品配成溶液,取一定量溶液置于锥形瓶中,加入指示剂,用碘水滴定。回答下列各题:
①实验中滴定管应选择_________(填酸式或碱式)滴定管,滴定前可以选择_____作为指示剂,滴定终点时的现象为_________________。
②下列操作测得硫代硫酸钠的含量偏大的是(__________)
A.滴定前滴定管内有气泡,滴定后气泡消失
B.读取碘水体积刻度时,滴定前平视,滴定后俯视
C.滴定过程中,锥形瓶震荡过于剧烈,有少量溶液溅出
D.滴定管用蒸馏水洗净后,直接加入碘水溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是不同温度下水的离子积常数:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则Kw________1×10-14(填“>”、“<”或“=”),做此判断的理由是___________________。
(2)t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的顺序是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色的配合物,是合成其它一些含钴配合物的原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图,回答下列问题:
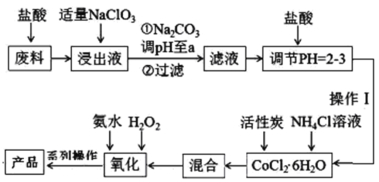
已知:①“浸出液”中含有Co2+、Fe2+、Fe3+、Al3+等
②Ksp[Co(OH)2]=6×10-15、Ksp[Co(OH)3]=1.6×10-44
(1)加“适量NaClO3”的作用是___,发生反应的离子方程式为___。
(2)“加Na2CO3调pH至a”会生成两种沉淀,分别为___(填化学式)。
(3)操作Ⅰ的步骤包括___、___、减压过滤。
(4)流程中“氧化”过程应先加入___(填“氨水”或“H2O2”),需水浴控温在50~60℃,温度不能过高,原因是___。写出“氧化”步骤发生反应的离子方程式:___,若无活性炭作催化剂,所得固体产物中除[Co(NH3)6]Cl3外还会有大量二氯化一氯五氨合钴[Co(NH3)5Cl]Cl2和三氯化五氨一水合钴[Co(NH3)5H2O]Cl3晶体,这体现了催化剂的___性。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式________。
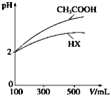
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)。
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中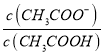 =____________。
=____________。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A. C生成的速率是A反应速率的2倍
B. A、B、C的浓度不再变化
C. 单位时间内生成nmol A,同时生成3nmol B
D. A、B、C的分子数之比为1∶3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理的有关知识回答下列问题:
(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)△H=-989.2 kJ·mol-1,有关键能数据如下表:
化学键 | Si-O | O=O | Si-Si |
键能kJ·mol-1 | X | 498.8 | 176 |
则X的值为_________。
(2)加热N2O5,依次发生的分解反应为①N2O5![]() N2O3+O2,②N2O3
N2O3+O2,②N2O3![]() N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。
N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 在密闭容器中有反应:A+xB(g) | A非气体、x=1 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 向5mL 0.005mol·L-1 FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1 mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com