
科目: 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO 部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、
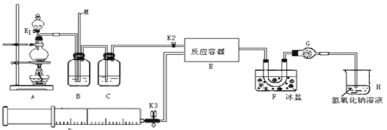
试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式__________。
(2)装置B的作用是 ①__________,②____________。
(3)若用A装置制取NO气体,B中应该盛放_________。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为___。
(5) 简述检查A、B、C所组成的实验装置气密性的操作_________。
(6)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与________________同时通入NaOH溶液中。
(7)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明 HNO2是弱酸:____________。(仅提供的试剂:1 molL-1HCl、 1 molL-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0 g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,用0.20 molL-1 AgNO3标准溶液滴定至终点,根据表中所给信息,应选用____________做指示剂,滴定终点的现象是______。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3 ×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是( )
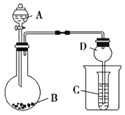
A.若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生沉淀后沉淀又溶解
D.实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目: 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )

A.图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为硫酸亚铁
B.原溶液中硫酸浓度为2.5 mol·L-1
C.原混合溶液中硝酸根离子的物质的量为0.2 mol
D.图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,对于pH=11的氨水,下列判断正确的是
A. 该氨水的浓度为1.0×10-3mol·L-1
B. 加水稀释,溶液中所有离子的浓度均减小
C. 加水稀释,溶液中c(NH4+)/c(NH3·H2O)变大
D. 与pH=3的盐酸等体积混合,反应后溶液pH=7
查看答案和解析>>
科目: 来源: 题型:
【题目】I.氮是地球上含量丰富的一种元素,氨、肼(N2H4)、尿素、偏二甲肼(C2H8N2)是氮的常见化合物,在科学技术和生产中有重要的应用。
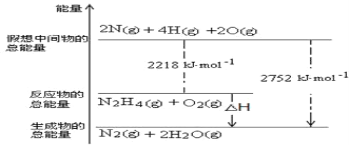
(1)肼(N2H4)是一种高能燃料,写出肼的电子式________,有关化学反应的能量变化如下图所示,已知H2O(g)=H2O(l) ΔH=-44kJ·mol-1,写出肼燃烧的燃烧热的热化学方程式为__________。
(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为____________。
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molN2、3molH2 | 2molNH3 | 2molNH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/molL-1 | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/molL-1min-1 | υ甲 | υ乙 | υ丙 |
则平衡时容器的体积V甲____________V丙,平衡常数K丙_________K乙(填>、<或=)
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)H2NCOONH4(氨基甲酸铵)(l) △H1 ,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是________
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
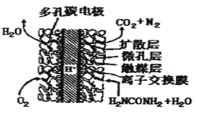
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】痛灭定钠是一种吡咯乙酸类的非甾体抗炎药,其合成路线如下:
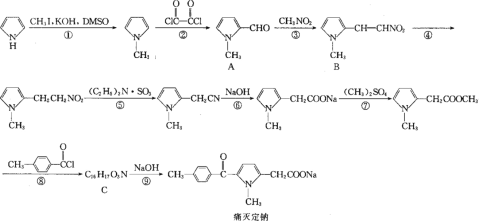
回答下列问题:
(1)化合物 A 中含氧官能团的名称是______。检验该官能团的化学反应方程式为______。
(2)化学反应①和④的反应类型分别为________和______。
(3)化学物B与等物质的量的Br2加成,最多生成_____种产物(不考虑顺反异构)。
(4)化合物 C 的结构简式为________。
(5)反应⑦的化学方程式为_______。
(6)芳香族化合物X的相对分子质量比A大14,写出遇FeCl3溶液显紫色且取代基仅位于苯环对位上化合物X的结构简式:______(不考虑立体异构)。
(7)根据该试题提供的相关信息,设计由化合物 ![]() 及必要的试剂制备有机化合物
及必要的试剂制备有机化合物![]() 的合成路线图___。
的合成路线图___。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,A为新型高效的甲烷燃料电池,采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料、电解质溶液见图。
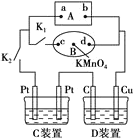
(1)甲烷燃料电池正极、负极的电极反应式分别为____;____。
(2)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向d端移动,则电源a端为___极,通电一段时间后,观察到滤纸c端出现的现象是_____。
(3)已知C装置中溶液为AgNO3溶液,D装置的溶液为Cu(NO3)2溶液,打开K1,关闭K2,通电一段时间后,D装置中Cu极的电极反应式为____,C装置中总反应的离子方程式为___。
(4)若C装置中AgNO3溶液足量,且溶液体积为1L,电解一段时间后,C装置中产生O2的体积为0.56 L(标准状况下),则电路通过的电子的物质的量为___,溶液的pH为___(忽略溶液体积变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度和压强下,把装有NO和NO2的混合气体的试管倒立于水中,充分反应后,试管内气体的体积缩小为原气体体积的![]() ,则原混合气体中NO和NO2的体积比为( )
,则原混合气体中NO和NO2的体积比为( )
A. 3∶lB. 1∶3C. 2∶3D. 3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是重要的工业原材料,现有铜、氧化亚铜组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固体物质完全反应,生成一氧化氮4.48 L(标准状况)。向所得溶液中加入aL 2.0 mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子沉淀完全。
(1)氧化亚铜与稀硝酸反应的化学方程式为_______________。
(2)混合物中,铜的物质的量为____________;氧化亚铜的物质的量为______________。
(3)所加氢氧化钠溶液的体积是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com