
科目: 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ/mol.
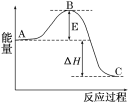
请回答下列问题:
(1)图中A、C分别表示___、___,E的大小对该反应的反应热有无影响?____。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___,理由是____。
(2)图中ΔH=___kJ/mol.
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:____。
(4)如果反应速率v(SO2)为0.05mol/(L·min),则v(O2)=___mol/(L·min)、v(SO3)=____mol/(L·min)。
(5)已知单质硫的燃烧热为296kJ/mol,计算由S(s)生成3molSO3(g)的ΔH(要求计算过程)。____
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,某二元碱![]() 水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是( )
水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是( )
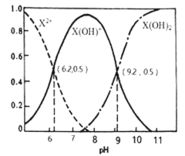
A.![]() 的数量级为
的数量级为![]()
B.![]() 水溶液显碱性
水溶液显碱性
C.等物质的量的![]() 和
和![]() 混合溶液中
混合溶液中![]()
D.在![]() 水溶液中,
水溶液中,![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为![]() 下列关于该电池的说法不正确的是( )
下列关于该电池的说法不正确的是( )
A.充电时,若转移![]() ,石墨(
,石墨(![]() )电极将增重
)电极将增重![]()
B.充电时,阳极的电极反应式为![]()
C.放电时,![]() 在电解质中由负极向正极迁移
在电解质中由负极向正极迁移
D.放电时,负极的电极反应式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为![]() ,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
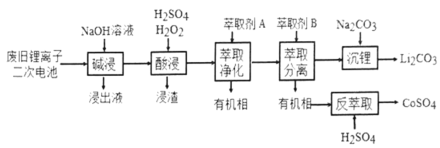
回答下列问题:
(1)“碱浸”目的是___________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为:_____________。浸渣含有的主要成分是_________。
发生反应的离子方程式为:_____________。浸渣含有的主要成分是_________。
(3)“萃取净化”除去的杂质离子有![]() 外,还有__________。
外,还有__________。
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,pH一般选择5左右,理由是______________。

(5)“沉锂”中![]() 溶解度随温度变化曲线如下图所示:
溶解度随温度变化曲线如下图所示:
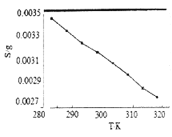
①根据平衡移动原理分析![]() 在水中溶解度随温度变化的原因____________________。
在水中溶解度随温度变化的原因____________________。
②为获得高纯![]() ,提纯操作依次为趁热过滤、________、烘干。
,提纯操作依次为趁热过滤、________、烘干。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知稀硝酸和铜能发生反应,生成硝酸铜、一氧化氮气体和水。
(1)请写出该反应的化学方程式,并用双线桥法标出反应中电子转移的方向和数目。________
(2)一次实验中,某同学用过量的稀硝酸(其密度为1.08 g·mL-1,HNO3的质量分数为12%)跟一定量的铜片反应,产生了标准状况下0.56 L的一氧化氮。试计算(简要写出计算过程):
①该稀硝酸的物质的量浓度(结果保留小数点后一位);______________
②被还原的HNO3的物质的量。________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某温度时,水的离子积为KW=1×10-13,则该温度___25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为_____。
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和。已知Va>Vb,且a=0.5b,此溶液中各种离子的浓度由大到小的排列顺序是:____,a的取值范围____。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯![]() 是一种高效、安全的消毒剂,常温下是一种黄绿色气体,11℃时液化成红棕色液体,易溶于水但不与水反应。工业上著名的开斯汀法制备二氧化氯的部分流程图如图1。某研究小组用图2装置模拟
是一种高效、安全的消毒剂,常温下是一种黄绿色气体,11℃时液化成红棕色液体,易溶于水但不与水反应。工业上著名的开斯汀法制备二氧化氯的部分流程图如图1。某研究小组用图2装置模拟![]() 发生器中的反应来制备
发生器中的反应来制备![]() (夹持装置已略去)
(夹持装置已略去)
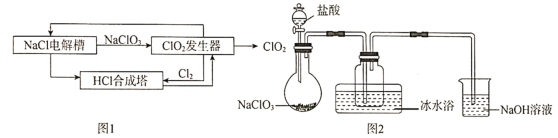
(1)写出![]() 与盐酸反应的化学方程式。_____________
与盐酸反应的化学方程式。_____________
(2)冰水浴的作用是_____________。
(3)![]() 溶液中发生的主要反应的离子方程式为_______。
溶液中发生的主要反应的离子方程式为_______。
(4)将![]() 通入到
通入到![]() 溶液中,再向其中加入适量
溶液中,再向其中加入适量![]() ,振荡、静置,观察到_________,证明
,振荡、静置,观察到_________,证明![]() 具有氧化性。
具有氧化性。
(5)![]() 常用作自来水消毒剂,碘量法可以检测水中
常用作自来水消毒剂,碘量法可以检测水中![]() 的浓度,步骤如下:
的浓度,步骤如下:
①取![]() 水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝(已知
水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝(已知![]() 全部转化为
全部转化为![]() );
);
②用![]() 的
的![]() 溶液滴定,消耗
溶液滴定,消耗![]() 溶液
溶液![]() (已知:
(已知: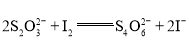 );
);
确定操作②达到滴定终点的现象是______;经计算,水样中![]() 的浓度是_________
的浓度是_________![]() 。
。
(6)一定温度和电压下,电解精制食盐水可制得![]() 和
和![]() 。
。
已知 ,电解时应选用___交换膜(填“阳离子”或“阴离子”),阴极电极反应式为___。
,电解时应选用___交换膜(填“阳离子”或“阴离子”),阴极电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6kJ/mol.实验测得起始、平衡时的有关数据如表:
2NH3(g) ΔH=-92.6kJ/mol.实验测得起始、平衡时的有关数据如表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】我国广泛采用将干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,用其取代氯气对自来水消毒,从而降低自来水中的氯残留对人体健康的影响。
(1)在ClO2分子中氯元素的化合价是______________。
(2)表示这一反应的化学方程式是________________________________,和欧洲的方法相比,我国这一方法的主要优点是生产出的ClO2中不含Cl2杂质。
(3)在酸性溶液中,用草酸钠(Na2C2O4)还原NaClO3也可制得ClO2,表示这一反应的化学方程式是________________________________,此法的优点是ClO2可被CO2稀释(Na2C2O4的氧化产物是CO2)。
(4)根据上述原理,北京绿先锋环保科技有限责任公司生产的“绿先锋消毒剂”是由两组固体试剂组成的。其使用方法见下图:
小瓶内盛的白色固体是________________,瓶胆内盛的白色固体是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国具有悠久的历史,在春秋时期已经开始冶铁,在西汉就有湿法炼铜( )。
)。
(1)基态铁原子的电子排布式为![]() _______。
_______。
(2)铁氰化钾![]() 是检验
是检验![]() 的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是_______,碳原子的杂化类型是________。
的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是_______,碳原子的杂化类型是________。
(3)![]() 是一种浅黄色液体,熔点
是一种浅黄色液体,熔点![]() ,沸点103℃,易溶于苯等有机溶剂,不溶于水。
,沸点103℃,易溶于苯等有机溶剂,不溶于水。![]() 是_________分子(填“极性”或“非极性”)
是_________分子(填“极性”或“非极性”)
(4)铜常见化合价为![]() 、
、![]() 价,高温下
价,高温下![]() 比
比![]() 更稳定的原因是__________。
更稳定的原因是__________。
(5)![]() 比
比![]() 的熔点高的原因是_____________。
的熔点高的原因是_____________。
(6)一种铜的溴化物晶胞结构如图所示,由图可知,该晶体的化学式为_____________,与每个![]() 紧邻的
紧邻的![]() 有___________个,由图中的P点和Q点的原子坐标参数,可确定R点的原子坐标参数为_____。若
有___________个,由图中的P点和Q点的原子坐标参数,可确定R点的原子坐标参数为_____。若![]() 原子与最近的
原子与最近的![]() 原子的核间距为
原子的核间距为![]() ,则该晶体的密度计算表达式为
,则该晶体的密度计算表达式为![]() ______
______![]() 。
。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com