
科目: 来源: 题型:
【题目】利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
2Fe+Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褐色硬块的组成。
(1)将褐色硬块处理成粉末状。研究小组首先排除了含有单质Al杂质的可能性,实验方法是________,证明不含单质铝的现象是_____________。
(2)该褐色硬块的组成基本确定为Fe、Fe2O3,Al2O3。请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20% KSCN、3 mol·L-1NaOH、3 mol·L-1HCl、3 mol·L-1HNO3、3 mol·L-1CuSO4、0.01 mol·L-1KMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。_____________。
实验操作 | 预期现象和结论 |
步骤1: | |
步骤2: | |
步骤3: | |
步骤4: |
查看答案和解析>>
科目: 来源: 题型:
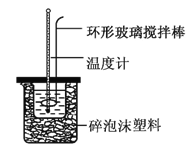
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是__________。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH=__[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如果用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_______(填“偏大”、“偏小”或“不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是_________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
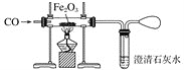
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由于我国煤储藏量相对比石油和天然气丰富,能源消费以煤为主。将原煤作为燃料燃烧,既严重污染环境,效率又不高,因而国家大力提倡煤的综合利用。实施“煤变油”,其原理之一是先将煤与水蒸气制得水煤气(一氧化碳和氢气),再催化合成甲醇或烃类等液态能源。
(1)用一氧化碳和氢气合成甲醇的化学方程式是______________________________________。
(2)用一氧化碳和氢气合成烃(CnHm)的化学方程式是__________________________。
(3)气化和液化的优点是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究氢的获得和应用具有重要意义。
(1)已知:![]() 将0.20molH2S气体充入密闭容器中,保持恒压(p=a)、温度T1条件下进行上述反应。
将0.20molH2S气体充入密闭容器中,保持恒压(p=a)、温度T1条件下进行上述反应。
①下列可以作为反应达到平衡状态的判据是________。
A.气体的平均相对分子质量不变
B.![]()
C.K不变
D.容器体积不变
②![]() 时刻反应达到平衡,H2S的平衡转化率为40%。该反应的平衡常数Kp=________(用a的代数式表示。对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
时刻反应达到平衡,H2S的平衡转化率为40%。该反应的平衡常数Kp=________(用a的代数式表示。对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③反应温度T1时,画出0~t2时段,n(S2)随时间变化曲线[n(S2)—t]。保持其它条件不变,改变反应温度为T2(T2>T1),画出0~t2时段,n(S2)随时间变化趋势的曲线[n(S2)—t]________
(2)已知:某催化剂作用下,H2还原NO的反应有两种可能:
Ⅰ.![]()
Ⅱ.![]()
反应历程可以表示为(![]() 表示吸附态)
表示吸附态)
吸附分解:![]() ①
①
![]() ②
②
反应脱附:![]() ③
③
![]() ④
④
![]() ⑤
⑤
其中,反应脱附过程中④与⑤是一组竞争关系,决定了H2还原NO的最终产物。
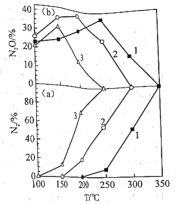
①如图显示不同温度条件下,原料气![]() ,达到平衡时体系中N2和N2O的含量,由此判断
,达到平衡时体系中N2和N2O的含量,由此判断![]() ________0(填“>”或“<”);判断反应脱附过程中④与⑤两步反应的活化能高低并说明理由________。
________0(填“>”或“<”);判断反应脱附过程中④与⑤两步反应的活化能高低并说明理由________。

②如图显示不同温度条件下,原料气![]() 分别为1、2、3(对应图中标注“1”、“2”、“3”),达到平衡时,体系中N2和N2O的含量,由此可知,增加H2的量,可以增加________的选择性(填“N2”或“N2O”)
分别为1、2、3(对应图中标注“1”、“2”、“3”),达到平衡时,体系中N2和N2O的含量,由此可知,增加H2的量,可以增加________的选择性(填“N2”或“N2O”)
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应中的能量变化是人类获取能量的中重要途径
(1)液化气是一种重要的家庭燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是(______)
A.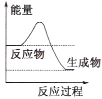 B.
B.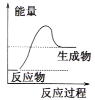 C.
C.
(2)"冰袋"可用于短时间保鲜食物。将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间那部分,使两种晶体分开,做成“冰袋”。使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温。由此判断:碳酸钠晶体与硝酸铵晶体的总能量_____(填“高于”或“低于”)反应后生成物的总能量
(3)化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化。比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为______和_____;人们普遍使用的干电池工作时是将化学能转化为_____
(4)下列反应中,属于放热反应的是____,属于吸热反应的是_____。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ②燃烧木炭取暖
③炸药爆炸 ④酸与碱的中和反应
⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(5)已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496kJ的能量,形成水分子中的1molH—O键要放出463 kJ的能量,试计算2H2+O2=2H2O反应中的ΔH=___kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】吗氯贝胺是新一代缓和的抗抑郁药物,某研究小组设计如图合成路线:
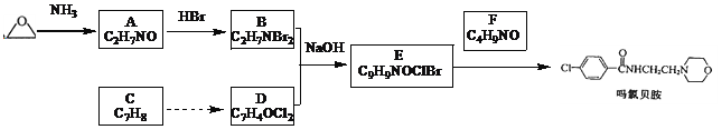
已知:①R-Br![]()
②R-COOH![]() R-COCl
R-COCl![]() R-CONHR′
R-CONHR′
③苯环上连羧基时,苯环上再取代主要生成间位取代产物。
按要求回答下列问题:
(1)化合物![]() 的结构简式________。
的结构简式________。
(2)下列有关说法正确的是________。
A.吗氯贝胺的分子式为![]()
B.在水中溶解能力![]() ,原因是
,原因是![]() 与水分子间可形成氢键
与水分子间可形成氢键
C.![]() 的反应中
的反应中![]() 的作用是反应产生氨基及中和反应产生的酸
的作用是反应产生氨基及中和反应产生的酸
D.![]() 吗氯贝胺的反应类型为取代反应
吗氯贝胺的反应类型为取代反应
(3)写出![]() 的反应方程式________。
的反应方程式________。
(4)![]() 与
与![]() 反应制备吗氯贝胺中加适量碳酸钾或过量
反应制备吗氯贝胺中加适量碳酸钾或过量![]() 均有利于提高产率,用反应方程式解释加过量
均有利于提高产率,用反应方程式解释加过量![]() 有利于提高产率的原因________。
有利于提高产率的原因________。
(5)设计![]() 的合成路线(用流程图表示,无机试剂任选)________。
的合成路线(用流程图表示,无机试剂任选)________。
(6)写出化合物![]() 同时符合下列条件的同分异构体的结构简式________。
同时符合下列条件的同分异构体的结构简式________。
①![]() 谱检测表明:分子中有3种氢原子;
谱检测表明:分子中有3种氢原子;
②![]() 谱检测表明:分子中存在
谱检测表明:分子中存在![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.实验室可用![]() 与浓盐酸在加热条件下制得
与浓盐酸在加热条件下制得![]()
B.![]() 溶液经过蒸发结晶转化为
溶液经过蒸发结晶转化为![]() ,再直接加热脱水即可得
,再直接加热脱水即可得![]()
C.铝热反应可用于焊接铁轨、冶炼难熔金属
D.硝酸分别与甲苯、甘油在合适的条件下反应,均可制得炸药
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验说法,不正确的是( )
A.苯酚不慎沾到皮肤上,应立即用酒精洗涤,再用大量水冲洗
B.排除碱式滴定管尖嘴的气泡时,应挤压玻璃球,使液体快速流出,向下冲出气泡
C.可用新制的![]() 悬浊液检验牙膏中存在的甘油
悬浊液检验牙膏中存在的甘油
D.利用硝酸银、稀硝酸可鉴别![]() 和
和![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是丁醇的两种同分异构体,其键线式、沸点如表所:
异丁醇 | 叔丁醇 | |
键线式 |
|
|
沸点/℃ | 108 | 82.3 |
下列说法不正确的是( )
A.异丁醇分子是由异丁基、羟基构成的
B.异丁醇的核磁共振氢谱有四组峰,且面积之比是![]()
C.表中沸点数据可以说明烃基结构会明显影响有机物的物理性质
D.异丁醇、叔丁醇在一定条件下经催化氧化可分别生成异丁醛、叔丁醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com