
科目: 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知电解质溶液电导率越大导电能力越强。常温下用![]() 溶液分别滴定
溶液分别滴定![]() 浓度均为
浓度均为![]() 的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )。
的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )。
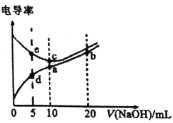
A.c点的混合液pH=7
B.e、d两点溶液混合后的溶液中:![]()
C.b点溶液中:![]()
D.a、b、c三点溶液中水的电离程度:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是磷酸、亚磷酸、次磷酸的结构式,其中磷酸为三元中强酸,亚磷酸为二元弱酸,则下列说法正确的是( )。
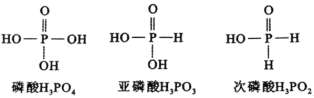
A.磷酸(![]() )的电离方程式为:
)的电离方程式为:![]()
B.亚磷酸(![]() )与足量NaOH溶液反应生成
)与足量NaOH溶液反应生成![]()
C.![]() 溶液呈酸性,是因为
溶液呈酸性,是因为![]() 的水解程度比电离程度大
的水解程度比电离程度大
D.![]() 溶液呈碱性
溶液呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成,据此判断,下列说法正确的是

A.上述反应不能说明钠比铜活泼
B.上述反应过程中只有一个氧化还原反应发生
C.加热且无水条件下,Na可以与CuSO4反应并生成Cu
D.依据上述反应可说明钠可以从任意铜盐溶液中置换出铜
查看答案和解析>>
科目: 来源: 题型:
【题目】下列操作或装置,不能达到实验目的的是( )。

A.图Ⅰ用于实验室制氨气并收集干燥的氨气
B.图Ⅱ用于检验浓硫酸与铜反应后的产物中是否含有铜离子
C.图Ⅲ用于验证牺牲阳极的阴极保护法
D.图Ⅳ用于制取![]() 晶体
晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是( )。
为阿伏加德罗常数的值。下列说法正确的是( )。
A.![]() 与
与![]() 的混合物,含离子总数为
的混合物,含离子总数为![]()
B.已知![]() 中铬元素的化合价为
中铬元素的化合价为![]() 价,则
价,则![]() 分子中存在的过氧键数目为
分子中存在的过氧键数目为![]()
C.![]() 溶液完全反应,转移电子数目一定为
溶液完全反应,转移电子数目一定为![]()
D.常温时,![]() 的盐酸中水电离的
的盐酸中水电离的![]() 数目为
数目为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识。下列说法错误的是( )。
A.“水声冰下咽,沙路雪中平”未涉及化学变化
B.《吕氏春秋·别类编》中“金(即铜)柔锡柔合两柔则刚”体现了合金硬度方面的特性
C.“司南之(勺),投之于地,其柢(柄)指南”。司南中“杓”所用材质为![]()
D.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”里的“碱”是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有
是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有![]() 、
、![]() 和少量
和少量![]() 、
、![]() )中提取,其工艺流程如下:
)中提取,其工艺流程如下:

已知:①![]()
②一些金属阳离子沉淀的pH范围:
开始沉淀pH | 完全沉淀pH | |
| 6.5 | 9.0 |
| 2.2 | 3.5 |
| 4.1 | 5.4 |
(1)“酸浸还原”时![]() 转化为
转化为![]() ,写出有关
,写出有关![]() 反应的离子方程式________;经“氧化”后钒以
反应的离子方程式________;经“氧化”后钒以![]() 存在,写出生成
存在,写出生成![]() 反应的离子方程式________。
反应的离子方程式________。
(2)调节溶液![]() 至2.0~3.5,宜选用的试剂是________(填标号)。/span>
至2.0~3.5,宜选用的试剂是________(填标号)。/span>
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)“滤渣1”的主要成分是________;![]() 粗品中的杂质为________。
粗品中的杂质为________。
(4)“沉钒”时需加入稀![]() ,其目的是________。
,其目的是________。
(5)焙烧产生的气体用________吸收后,其产物可以在该工艺中循环利用。
(6)![]() 在一定条件下可转化为不同价态的钒离子(
在一定条件下可转化为不同价态的钒离子(![]() 、
、![]() 、
、![]() 、
、![]() ),可作为全钒液充电流电池的电极液,电池总反应为
),可作为全钒液充电流电池的电极液,电池总反应为![]() 。下图是钒电池基本工作原理示意图:
。下图是钒电池基本工作原理示意图:
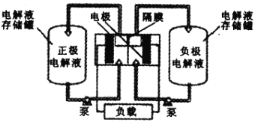
充电时阳极的反应式为____;能够通过钒电池基本工作原理示意图中“隔膜”的离子是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com